Tests de viabilité cellulaire en présence de médicaments sur des sphéroïdes tumoraux 3D à l’aide de l’imagerie macro-micro automatisée
Introduction
L’observation microscopique est un moyen efficace d’évaluer les effets médicinaux des agents anticancéreux sur les sphéroïdes ou les organoïdes. Le processus d’imagerie peut cependant s’avérer chronophage, car il faut passer beaucoup de temps au microscope pour trouver l’échantillon et effectuer l’imagerie.
Nous avons développé un module d’imagerie automatisé novateur qui améliore considérablement l’efficacité de ces tâches. L’imagerie macro-micro automatisée peut remplacer les tâches manuelles de microscopie grâce à l’imagerie et à la détection d’objets automatisées. Dans la présente note d’application, nous décrivons une étude de cas sur les tests de viabilité cellulaire en présence de médicaments sur des sphéroïdes tumoraux 3D à l’aide de l’imagerie macro-micro automatisée.
Matériel et méthodes : préparation des échantillons
Une plaque de 96 puits à fond rond (PrimeSurface, Sumitomo Bakelite) a été ensemencée par des cellules de la lignée cellulaire de cancer du sein humain MCF-7 à raison de 2 000 cellules/puits. Au troisième jour de culture, des agents anticancéreux (paclitaxel, 5-FU, cisplatine) ont été ajoutés à différentes concentrations. Après 24 heures de culture, de l’Hoechst 33342, de l’iodure de propidium (PI) et de la calcéine-AM ont été ajoutés et incubés pendant une heure. Les noyaux de toutes les cellules étaient marqués à l’Hoechst 33342, les noyaux des cellules mortes étaient marqués à l’iodure de propidium et les cellules vivantes étaient marquées à la calcéine-AM. Les cellules ont ensuite été observées à l’aide du module logiciel d’imagerie macro-micro automatisée sur le microscope confocal à balayage laser Olympus FV3000.
Comment fonctionne l’imagerie macro-micro automatisée ?
Avec l’imagerie macro-micro automatisée, les tâches suivantes peuvent être effectuées automatiquement en définissant simplement les méthodes d’observation à l’avance.
Tout d’abord, l’imagerie macro-micro automatisée prend une vue d’ensemble de tout le puits (y compris selon l’axe Z) à l’aide d’un objectif de faible grossissement (objectif 1,25X à 4X). À partir de l’image obtenue (image macro), la position et l’épaisseur de l’échantillon dans chaque puits sont automatiquement détectées. Ensuite, la position optimale pour exécuter l’imagerie (XYZ) est calculée et l’image détaillée de l’échantillon est prise à l’aide d’un objectif de fort grossissement (image micro). Si l’échantillon est plus grand que le champ de vision de l’objectif utilisé pour l’imagerie micro, le système peut automatiquement assembler plusieurs images (figure 1).
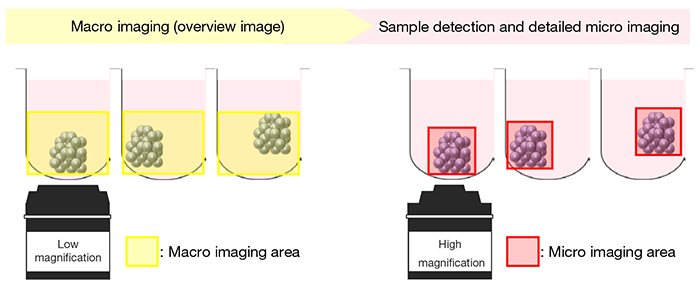
Figure 1. Représentation schématique de l’imagerie macro à micro
Le travail au microscope prend environ 15 à 20 minutes et n’est nécessaire que pour configurer les méthodes d’observation initiales. Après l’exécution de l’imagerie macro-micro automatisée, l’utilisateur peut quitter le microscope et l’ordinateur pour effectuer d’autres tâches pendant que l’imagerie se termine. Le temps consacré à la manipulation du microscope est par conséquent considérablement réduit. De plus, même si l’épaisseur ou la position de l’échantillon varie d’un puits à l’autre, le système peut prendre des images avec l’étendue Z optimale pour chaque échantillon. Ainsi, l’imagerie est effectuée plus rapidement et la quantité de données d’imagerie est réduite.
Étapes de l’imagerie macro-micro

Résultats d’imagerie
Les sphéroïdes MCF7 traités avec divers agents anticancéreux ont été marqués à la calcéine-AM et à l’iodure de propidium afin de visualiser leur viabilité. En utilisant notre module d’imagerie macro-micro automatisée pour le microscope confocal FV3000, nous avons pu acquérir rapidement des images à haute résolution de 60 puits prises aux positions appropriées. La manipulation du microscope n’a duré que 15 minutes (figure 2).
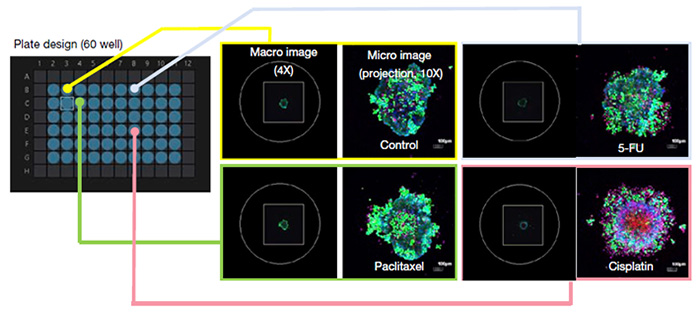
Figure 2. Adaptation du module d’imagerie macro-micro automatisée pour un test de viabilité cellulaire en présence d’agents anticancéreux
Le processus d’observation conventionnel nécessite de déterminer la position de l’échantillon un puits à la fois pour obtenir les conditions d’imagerie appropriées. En utilisant le module d’imagerie macro-micro automatisée, cette tâche est éliminée. De plus, le temps normalement consacré à l’imagerie peut être consacré à d’autres tâches, ce qui améliore l’efficacité du travail.
Résultats des analyses
En ouvrant les fichiers d’images acquis par le module d’imagerie macro-micro automatisée avec le logiciel d’analyse cellulaire 3D NoviSight™, les images multipuits peuvent être analysées en 3D simultanément.
Tous les noyaux ont été identifiés en fonction de l’intensité de la fluorescence du marquage à l’Hoechst 33342 des cellules MCF7. La viabilité des cellules a été évaluée en déterminant si les noyaux identifiés étaient des noyaux de cellules vivantes ou mortes d’après l’intensité de la fluorescence de la calcéine-AM et de l’iodure de propidium. Nous avons pu ainsi confirmer l’effet décrit dans la littérature de divers agents anticancéreux sur la viabilité cellulaire au niveau unicellulaire (figures 3 et 4).
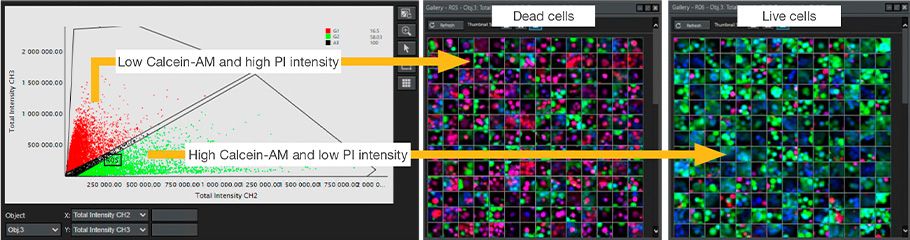
Figure 3. Classification au moyen du logiciel NoviSight des cellules vivantes ou mortes en fonction de l’intensité de la fluorescence de la calcéine-AM et de l’iodure de propidium
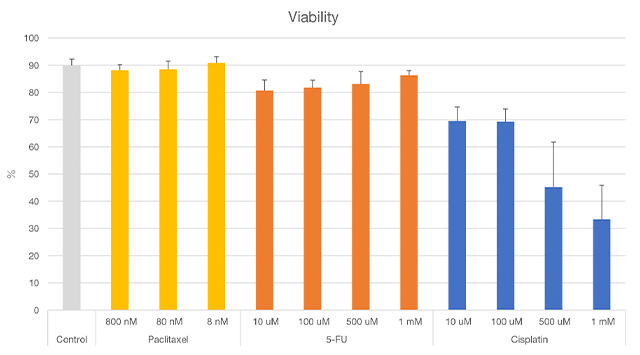
Figure 4. Résultats de l’analyse de la viabilité de sphéroïdes à l’aide du logiciel NoviSight
Conclusion
L’utilisation du module d’imagerie macro-micro automatisée nous a permis d’acquérir des images de 60 puits d’une microplaque, à des positions appropriées pour l’imagerie, après environ 15 minutes de manipulation du microscope et de l’ordinateur.
L’imagerie manuelle d’un puits à la fois nécessite généralement plus de six heures de travail intermittent au microscope et à l’ordinateur, temps d’imagerie compris. Avec le module d’imagerie automatisée, vous n’avez besoin de passer qu’environ 15 minutes au microscope et à l’ordinateur, et vous avez la possibilité d’effectuer d’autres tâches pendant que l’imagerie se termine.
De plus, en combinant l’imagerie macro-micro automatisée et le logiciel NoviSight, les images multipuits peuvent être analysées par lots. Cette configuration permet un processus fluide, de l’acquisition des images à l’analyse d’échantillons de sphéroïdes répartis dans plusieurs puits.
Mayu Ogawa
Chercheuse, R et D – Olympus Corporation
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.