Prüfung der Viabilität von 3D-Krebs-Sphäroiden nach Wirkstoffzugabe mit automatisierter Makro-Mikro-Bildgebung
Einführung
Mikroskopische Untersuchungen geben Aufschluss über die medizinische Wirkung von Krebsmedikamenten auf Sphäroide oder Organoide. Der Bildgebungsprozess kann jedoch viel Zeit kosten, da die Suche der Probe unter dem Mikroskop und die Bildaufnahme aufwändig sind.
Um diesen Prozess effektiver zu machen, haben wir ein innovatives Bildgebungsmodul entwickelt, das eine automatisierte Makro-Mikro-Bildgebung ermöglicht. Mit dieser automatisierten Makro-Mikro-Bildgebung werden Objekte automatisch erkannt und aufgenommen, sodass manuelle Arbeitsschritte am Mikroskop entfallen. In diesem Anwendungshinweis stellen wir eine Fallstudie zur Prüfung der Viabilität von 3D-Krebs-Sphäroiden nach Wirkstoffzugabe unter Verwendung der automatisierten Makro-Mikro-Bildgebung vor.
Materialien und Methoden: Probenvorbereitung
In einer 96-Well-Platte mit U-Boden (PrimeSurface, Sumitomo Bakelite) wurden pro Well 2.000 Zellen der humanen Brustkrebszelllinie MCF-7 ausgesät. Am dritten Tag der Kultur wurden Krebsmedikamente (Paclitaxel, 5-FU, Cisplatin) in verschiedenen Konzentrationen zugegeben. Nach 24 Stunden wurden Hoechst 33342, Propidiumiodid (PI) und Calcein-AM zugegeben und eine Stunde lang inkubiert. Die Kerne aller Zellen wurden mit Hoechst 33342, die Kerne abgestorbener Zellen mit PI und die Kerne lebender Zellen mit Calcein-AM gefärbt. Die Zellen wurden dann mit dem automatisierten Makro-Mikro-Softwaremodul des konfokalen Laser-Scanning-Mikroskops Olympus FV3000 untersucht.
Wie funktioniert die automatisierte Makro-zu-Mikro-Bildgebung?
Durch die Voreinstellung des Mikroskopieverfahrens können die folgenden Vorgänge mit der automatisierten Makro-Mikro-Bildgebung automatisch durchgeführt werden.
Im ersten Schritt wird bei der automatisierten Makro-Mikro-Bildgebung ein Übersichtsbild des gesamten Wells (einschließlich der Z-Achse) mit einem Objektiv mit geringer (1,25- bis 4-facher) Vergrößerung aufgenommen. Anhand des erzeugten Bildes (Makrobild) werden die Position und die Dicke der Probe in jedem Well automatisch erkannt. Anschließend wird die optimale Abbildungsposition (XYZ) berechnet und die Probe mit einem Objektiv mit hoher Vergrößerung im Detail abgebildet (Mikrobild). Wenn die Probe größer ist als das Sehfeld des Objektivs, das für die Mikrobildgebung verwendet wird, kann das System automatisch mehrere Bilder zusammenfügen (Abbildung 1).
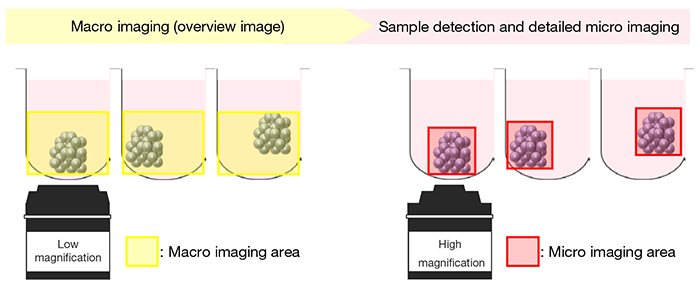
Abbildung 1. Schematische Darstellung der Makro-Mikro-Bildgebung
Die manuellen Schritte am Mikroskop dauern etwa 15 bis 20 Minuten und sind nur erforderlich, um die Mikroskopieverfahren am Anfang einzustellen. Nach der automatisierten Makro-Mikro-Bildgebung kann der Benutzer das Mikroskop und den PC verlassen, um andere Aufgaben zu erledigen, während die Bildgebung abgeschlossen wird. Auf diese Weise reduziert sich der Zeitaufwand für das Mikroskopieren deutlich. Selbst wenn die Dicke oder Position der Probe zwischen den Wells variiert, kann das System den optimalen Z-Bereich für jede Probe abbilden. Dadurch werden der zeitliche Aufwand für die Bildgebung und die Menge an Bildgebungsdaten reduziert.
Ablauf der Makro-Mikro-Bildgebung

Ergebnisse der Bildgebung
Mit verschiedenen Krebsmedikamenten behandelte MCF7-Sphäroide wurden mit Calcein-AM und PI angefärbt, um die Viabilität sichtbar zu machen. Durch den Einsatz unseres automatisierten Makro-Mikro-Bildgebungsmoduls für das konfokale Mikroskop FV3000 konnten wir in kürzester Zeit hochauflösende Bilder von 60 Wells an geeigneten Positionen aufnehmen. Die manuellen Schritte am Mikroskop erforderten einen Zeitaufwand von lediglich 15 Minuten (Abbildung 2).
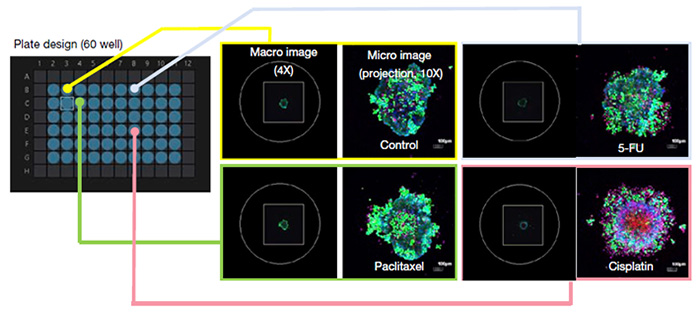
Abbildung 2. Anpassung des automatisierten Makro-Mikro-Bildgebungsmoduls zur Prüfung der Wirkung von Krebsmedikamenten
Bisher musste die Position der Probe in jedem einzelnen Well manuell festgelegt werden, um die richtigen Bildgebungsbedingungen zu erhalten. Mit dem automatisierten Makro-Mikro-Bildgebungsmodul entfällt dieser Schritt. Die bisher für die Bildgebung aufgewendete Zeit kann nun für andere Aufgaben genutzt werden, was die Arbeitseffizienz erhöht.
Analyseergebnisse
Werden die Bilddateien des automatisierten Makro-Mikro-Bildgebungsmoduls mit der NoviSight 3D-Zellanalysesoftware geöffnet, können die Bilder mehrerer Wells gleichzeitig in 3D analysiert werden.
Alle Zellkerne wurden anhand der Intensität von MCF7 Hoechst 33342 erkannt. Zur Bewertung der Viabilität wurde anhand der Intensität der Kernfärbung mit Calcein-AM und PI unterschieden, ob es sich um lebende oder abgestorbene Zellen handelte. So konnten wir die Viabilität der Zellen bzw. die Wirksamkeit jedes Krebsmedikaments erfolgreich auf Einzelzellebene in Übereinstimmung mit bekannten Berichten beurteilen (Abbildung 3 und Abbildung 4).
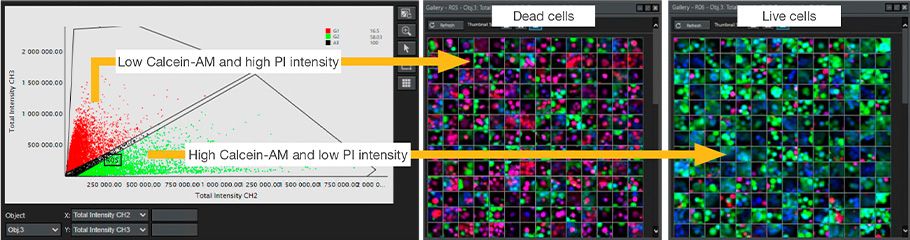
Abbildung 3. NoviSight Analyse zur Unterscheidung zwischen lebenden/abgestorbenen Zellen anhand der Intensität des Calcein-AM/PI-Färbesignals
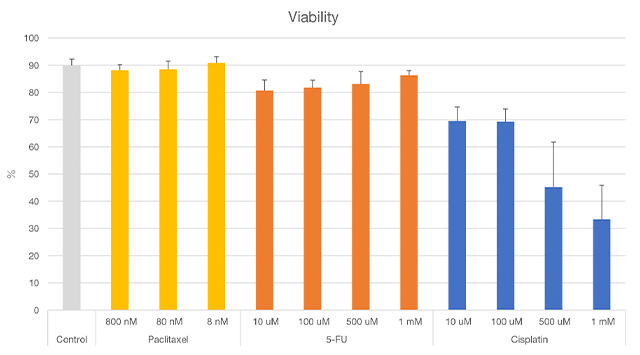
Abbildung 4. Ergebnisse der Viabilität von Sphäroiden mittels NoviSight Analyse
Zusammenfassung
Nach einer lediglich 15-minütigen Vorbereitung zur Einstellung des Mikroskops und des PCs konnten wir 60 Wells der Mikroplatte mit Hilfe des automatisierten Makro-Mikro-Bildgebungsmoduls an den entsprechenden Bildpositionen abbilden.
Wir gehen davon aus, dass die Bildgebung der einzelnen Wells bei einem rein manuellen Verfahren mehr als sechs Stunden dauern würde, da abwechselnd verschiedene Arbeitsschritte am Mikroskop und am PC durchgeführt werden müssten. Mit dem automatisierten Bildgebungsmodul beläuft sich der zeitliche Aufwand für die Bedienung des Mikroskops und des PCs auf gerade einmal 15 Minuten, und es lassen sich andere Aufgaben erledigen, während die Bildgebung durchgeführt wird.
Da neben der automatisierten Makro-Mikro-Bildgebung auch die NoviSight Software eingesetzt wurde, konnten die Bilder mehrerer Wells gleichzeitig analysiert werden. Diese Konfiguration ermöglicht einen nahtlosen Ablauf von der Bildaufnahme bis zur Analyse von Sphäroiden in Multi-Well-Platten.
Mayu Ogawa
Forschungsmitarbeiterin, F&E – Olympus Corporation
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.