Multiplexing mit dem FV3000 Konfokalmikroskop
Charakterisierung der Morphologie des medialen präfrontalen Kortex einer Maus
Die Untersuchung kognitiver Beeinträchtigungsmechanismen erfordert die Feststellung des Zusammenhangs zwischen morphologischen Veränderungen und physiologischen Reaktionen. Um zu wissen, wie sich Zustände und Behandlungen von Krankheiten auf die Gehirnmorphologie auswirken, ist es wichtig, mehrere morphologische Strukturen in einer Probe zu identifizieren. Für diese Studie wurde das FV3000 Konfokalmikroskop mit TruSpectral Detektoren eingesetzt, um sechs verschiedene Strukturen im medialen präfrontalen Kortex (mPFC) der Maus erfolgreich darzustellen: Astrozyten, Pyramidenneuronen, inhibitorische Neuronen, neuronale Membranen, Axon-Anfangssegmente und Kerne.
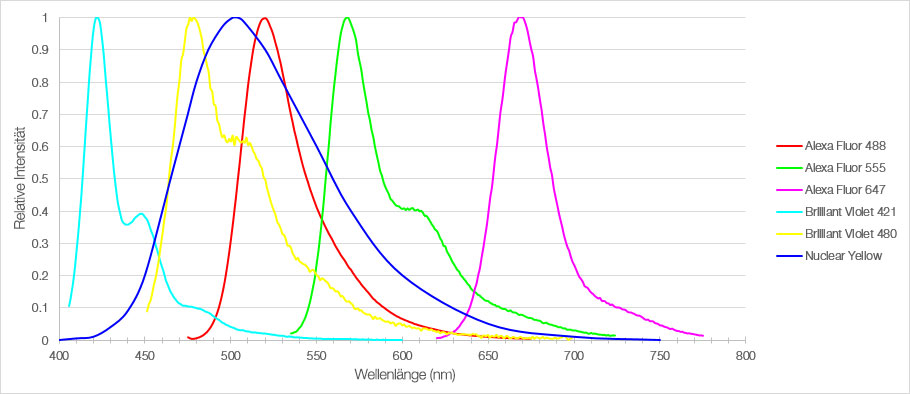
Abbildung 1: Emissionsspektren der sechs Fluorophore, die zur Färbung von Schnitten des medialen präfrontalen Kortex der Maus verwendet wurden.
Die TruSpectral Technologie ermöglicht eine eindeutige Identifizierung der sechs Strukturen
Für dieses Experiment wurde ein 30 µm dicker festgelegter Abschnitt des Maus-mPFC mit sechs verschiedenen Fluorophoren gefärbt. Es wurde ein FV3000 Konfokalmikroskop von Olympus mit einem UPLSAPO20X-Objektiv zur Erfassung von 3D-Fluoreszenzbildern des Multiplex-Hirngewebes verwendet. Mit der TruSpectral Erkennung wurden für jedes Fluorophor entsprechende Erfassungs- und Detektionsparameter festgelegt, um die Signalerkennung zu optimieren und ein Durchscheinen zu verhindern. Aus hellen Signalen jedes Fluorophors mit unterschiedlichen Emissionsprofilen wurde das Endbild erzeugt, auf dem mehrere Strukturen in der gleichen Probe genau erkennbar waren.
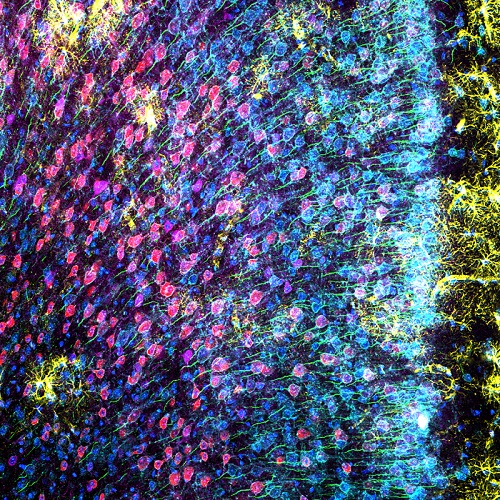
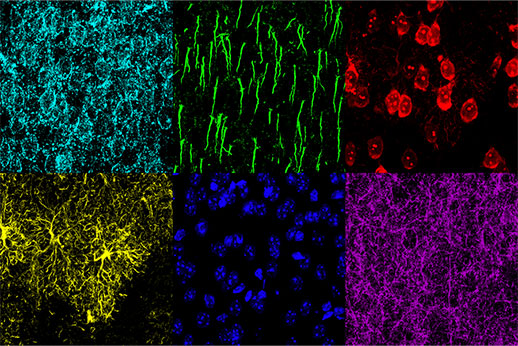
Abbildung 2: Maus-mPFC, gefärbt mit saurem Gliafibrillenprotein (GFAP; Astrozytenfärbung; gelb), Calmodulin-abhängiger Proteinkinase II (CaMKII; Pyramidenneuronenfärbung; rot), Amphoterin-induziertes-Protein-1-Vorstufe (AMIGO-1; neuronale Membranfärbung) ; Cyan), Parvalbumin (PV; inhibitorische Neuronenfärbung; lila), Ankyrin-G (AnkG; Axon-Initialsegmentfärbung; grün) und Nuclear Yellow (Kernfärbung; blau).
Bildgebungsbedingungen
Mikroskop: FLUOVIEW FV3000 konfokales Laser-Scanning-Mikroskop
Objektiv: 20X Luftobjektive (UPLSAPO20X)
Laser: 405 nm (BV421, Nuclear Yellow), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) und 640 nm (AF647)
100X Silikonöl-Objektive ermöglichen eine hohe Bildauflösung einzelner morphologischer Strukturen
Um hochaufgelöste Bilder des Maus-mPFC zu erhalten, wurde das 100X-Silikonölobjektiv mit hochempfindlichen TruSpectral Detektoren verwendet, um helle detaillierte Bilder eines Bereichs des Kortex mit sechs Färbungen zu erhalten. Diese Kombination ermöglichte eine deutliche Betrachtung der Morphologie der verschiedenen Neuronenpopulationen im medialen präfrontalen Kortex.
(A) | (B) |
Abbildung 3: Maus-mPFC, gefärbt mit saurem Gliafibrillenprotein (GFAP; Astrozytenfärbung; gelb), Calmodulin-abhängiger Proteinkinase II (CaMKII; Pyramidenneuronenfärbung; rot), Amphoterin-induziertes-Protein-1-Vorstufe (AMIGO-1; neuronale Membranmarkierung) ; Cyan), Parvalbumin (PV; inhibitorische Neuronenfärbung; lila), Ankyrin-G (AnkG; Axon-Initialsegmentfärbung; grün) und Nuclear Yellow (Kernfärbung; blau). (A) Einzelne Kanäle der sechs Fluorophore. (B) Überlagertes Bild
Bildgebungsbedingungen
Mikroskop: FLUOVIEW FV3000 konfokales Laser-Scanning-Mikroskop
Objektiv: 100X Silikonölobjektiv (UPLSAPO100XS)
Laser: 405 nm (BV421, Nuclear Yellow), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) und 640 nm (AF647)
Wie das konfokale Mikroskop FV3000 unsere Untersuchung erleichterte
Das Vollspektrumsystem mit hocheffizienten GaAsP-Detektoren bietet eine hohe Empfindlichkeit für die Multiplex-Bildgebung
| Die TruSpectral Detektionstechnologie ist in allen FV3000 Konfokalmikroskopen integriert und ermöglicht einen höheren Lichtdurchsatz im Vergleich zu herkömmlichen Spektralerkennungsgeräten. Das Volumenphasenhologramm beugt Licht mit bis zu dreifach höherer Transmissionseffizienz als Reflexionsgitter. Mit dem hochempfindlichen Spektraldetektor (HSD) des FV3000 Mikroskops lassen sich helle und schwache Signale durch unabhängige Anpassung der Empfindlichkeit jedes TruSpectral Detektors optimal trennen. Zudem ermöglicht der spektrale Dekonvulationsalgorithmus des FV3000 Systems die Trennung überlappender Spektren basierend auf den spektralen Informationen von Lambda-Stapelbildern. Gegenseitige Fluoreszenzstörungen zwischen den Kanälen können durch den Entmischungsalgorithmus sowohl bei der Live-Bildaufnahme als auch bei der Nachbearbeitung eliminiert werden, sodass eine saubere Trennung von bis zu sechzehn Fluorophoren möglich ist. | Related Videos |
UPLSAPO100XS Silikonöl-Immersionsobjektive für eine helle Bildgebung bei dicken Gewebeschnitten
Die Super-Apochromate UPLSAPO kompensieren sowohl sphärische als auch chromatische Aberrationen und haben eine hohe Transmission vom sichtbaren bis zum nahen Infrarotspektrum. Der Brechungsindex von Silikonöl (ne≈1,40) entspricht fast dem von lebendem Gewebe (ne≈1,38) und ermöglicht hochauflösende Beobachtungen tief im lebenden Gewebe mit minimaler sphärischer Aberration und genauer 3D-Morphologie.
|
Vergrößerung: 100X
NA: 1,35 (Silikonöl-Immersionsobjektiv) Arbeitsabstand: 0,2 mm Korrektur von chromatischer Aberration: Super-Apochromat (SAPO) |
Verwendung des FV3000 Mikroskops zur Untersuchung der Auswirkungen neuropathischer Schmerzen auf das Gehirn auf molekularer Ebene
Kommentar von Stephanie Shiers
 | Schwerpunkt unserer Arbeit ist die vom medialen präfrontalen Kortex (mPFC) abhängige kognitive Beeinträchtigung bei neuropathischen Schmerzen. Wir untersuchen die strukturelle Plastizität des mPFC, um die an der kortikalen Dysfunktion beteiligten Zelltypen zu identifizieren und Einblicke in die funktionellen Veränderungen dieser Zellen zu erhalten. Wir haben eine Reduzierung der Länge der Axon-Initialsegmente (AIS) im mPFC männlicher Mäuse mit neuropathischen Schmerzen beobachtet, die mit Leistungseinbußen bei einer kognitiven Aufgabe korreliert (Shiers et al., J. Neurosci 2018, Shiers et al., Neuropsychopharmacology, 2019). Die Kenntnis über die Morphologie dieser Zelltypen liefert uns Hinweise darauf, was kognitiven Dysfunktionen bei Schmerzen zugrunde liegt und wie diese zu behandeln sind. Die hochauflösende Bildgebung des FV3000 Mikroskops war für unsere Analysen der mPFC-Mikroarchitektur von entscheidender Bedeutung. |
Kommentar von Dr. Theodore Price
 | Ein Hauptziel unsere Untersuchung ist es zu verstehen, wie sich neuropathischer Schmerz auf Gehirnstrukturen auswirkt, die eng an der kognitiven Verarbeitung beteiligt sind. Wir wissen, dass bei neuropathischen Schmerzen kognitive Begleiterkrankungen auftreten, aber bis jetzt ist nur wenig über die molekularen Grundlagen bekannt. Unsere Untersuchungen des Maus-PFC hat feine Veränderungen im AIS gezeigt, die durch neuropathische Schmerzen verursacht werden. Mit dem FV3000 Mikroskop konnten Bilder der Ultrastruktur des PFC von höchster Qualität erhalten werden, und somit wurden neue Wege geschaffen, diesen wichtigen Aspekt neuropathischer Schmerzen zu verstehen. |
Anmerkungen
Dieses Anwendungsbeispiel wurde mit der Unterstützung der folgenden Wissenschaftler realisiert:
Stephanie Shiers, Ph.D. Candidate, Price Lab, University of Texas, Dallas
Theodore J. Price, Ph.D., Price Lab, Eugene McDermott Professor, Director,
Center for Advanced Pain Studies, Department of Neurobiology, School of Behavioral and Brain Sciences, University of Texas, Dallas
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.