共焦点顕微鏡FV3000を用いたマルチプレキシング
マウス内側前頭前皮質の微細構造の解明
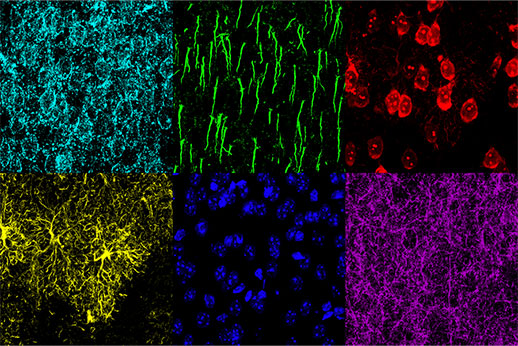
認知機能障害メカニズムの研究には、形態学的変化と生理学的反応の関連付けが必要です。また、疾患の程度や治療による脳の形態学的変化を理解するためには、同一サンプルにおける複数の形態学的構造を特定することが重要です。本研究では、TruSpectral分光検出器を搭載したFV3000を用いて、マウスの内側前頭前皮質(mPFC)におけるアストロサイト、錐体ニューロン、抑制性ニューロン、ニューロン細胞膜、軸索起始部および核の6種類の異なる構造の撮影に成功しました。
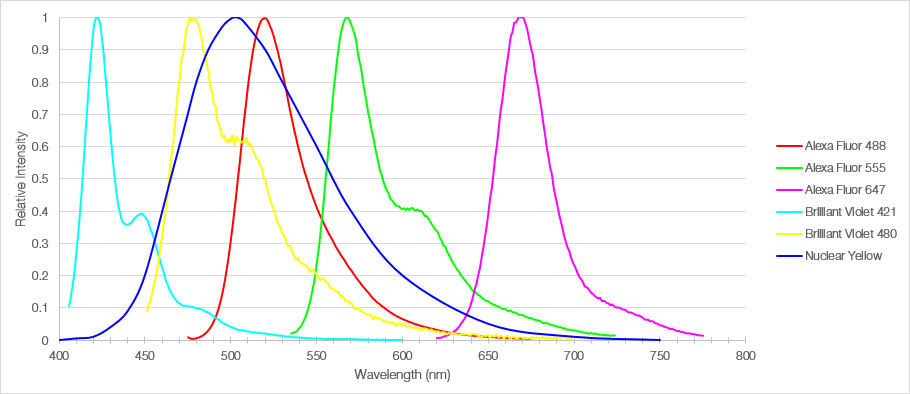
図1:マウス内側前頭前皮質切片のラベルに用いた6種類の蛍光色素の蛍光スペクトル
TruSpectralにより6種類の構造を明確に区別
本実験では、厚さ30μmのマウスmPFCの固定化切片を6種類の蛍光色素でラベルし、UPLSAPO20X対物レンズを搭載した共焦点顕微鏡FV3000を用いて、脳組織の3Dマルチカラー画像を撮影しました。TruSpectral分光検出器を用いてシグナル検出を最適化し、チャンネル間における蛍光のクロストークを最小にするために、蛍光色素ごとに検出パラメーターを設定しました。その結果、蛍光色素ごとに明るい画像を得ることができ、同一サンプル内で複数の構造を正確に確認することができました。
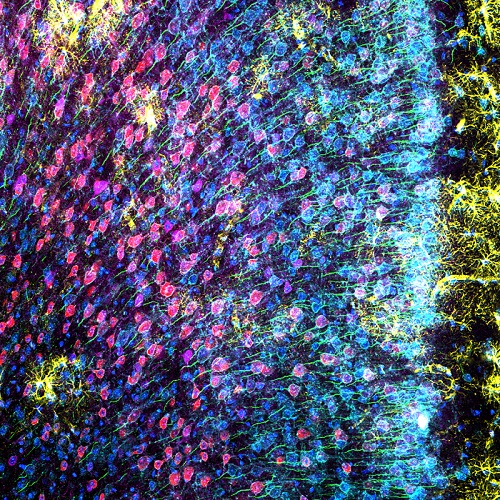
図2:Mouse mPFC labeled with glial fibrillary acidic protein (GFAP; astrocyte marker; yellow), calmodulin-dependent protein kinase II (CaMKII; pyramidal neuron marker; red), amphoterin-induced protein 1 precursor (AMIGO-1; neuronal membrane marker; cyan), parvalbumin (PV; inhibitory neuron marker; purple), ankyrin-G (AnkG; axon initial segment marker; green), and nuclear yellow (nuclei marker; blue).
撮影条件
対物レンズ:20倍ドライ対物レンズ(UPLSAPO20X)
顕微鏡:FLUOVIEW FV3000 (virtual channel mode)
レーザー:405nm(BV421、Nuclear Yellow)、445nm(BV480)、488nm(AF488)、561nm(AF555)および640nm(AF647)
100倍シリコーンオイル浸対物レンズによる形態構造の高解像画像の取得
マウスmPFCの高解像度画像を得るために、100倍シリコーンオイル浸対物レンズおよびTruSpectral高感度分光検出器を使用しました。その結果、6種類のマーカーでラベルされた皮質部分をより明るく高精細に撮影することができました。100倍シリコーンオイル浸対物レンズとTruSpectral高感度分光検出器を組み合わせることで、mPFC内のさまざまな種類のニューロンの形態を明瞭に観察することができました。
(A) | (B) |
図3: Mouse mPFC labeled with glial fibrillary acidic protein (GFAP; astrocyte marker; yellow), calmodulin-dependent protein kinase II (CaMKII; pyramidal neuron marker; red), amphoterin-induced protein 1 precursor (AMIGO-1; neuronal membrane marker; cyan), parvalbumin (PV; inhibitory neuron marker; purple), ankyrin-G (AnkG; axon initial segment marker; green), and nuclear yellow (nuclei marker; blue). (A) Individual channels of the six fluorophores. (B) Overlay image.
撮影条件
対物レンズ:シリコーンオイル浸対物レンズ(UPLSAPO100XS)
顕微鏡:FLUOVIEW FV3000 (virtual channel mode)
レーザー:405nm(BV421、Nuclear Yellow)、445nm(BV480)、488nm(AF488)、561nm(AF555)および640nm(AF647)
実験を可能にしたFV3000の技術
高効率GaAsP分光検出器で高感度のマルチカラー画像取得が可能
| 共焦点顕微鏡FV3000はTruSpectral分光検出器を搭載しており、従来の検出器と比べて検出効率の高い分光イメージングが可能です。透過型回折格子(Volume Phase Hologram diffraction grating)は、従来の反射型回折格子に比べ最大3倍の透過効率を実現しました。さらに、FV3000の特徴である高感度分光検出器(HSD)により、明るいシグナルも微弱なシグナルも波長帯域ごとに最適な感度で取得できます。また、近接した波長特性を持つ蛍光色素でラベルされたサンプルの場合、スペクトラム情報をもとに、スペクトラムデコンボリューションのアルゴリズムで分離することが可能です。多チャンネルで撮影された画像であっても、チャンネル間の蛍光のクロストークをアンミキシングのアルゴリズムで除去することが可能です。これらのアンミキシング処理は、最大16種類の蛍光色素に対して可能です。 | Related Videos |
シリコーンオイル浸対物レンズUPLSAPO100XSを用いて厚みのある組織切片の明るい画像取得を実現
スーパーアポクロマート対物レンズUPLSAPOは、球面収差や色収差を補正し、可視から近赤外領域において高い透過率特性を持っています。シリコーンオイルの屈折率(ne約1.40)は生組織の屈折率(ne約1.38)とほぼ同じであるため、屈折率の差によって生じる球面収差の影響を受けにくく、生組織の3D構造を高解像度で正確に撮影することができます。
|
倍率:100✕
NA:1.35(シリコーンオイル浸) W.D.:0.2 mm 色収差補正レベル:スーパーアポクロマート(SAPO) |
Stephanie Shiers氏からのコメント
 | 私達は、神経障害性疼痛におけるmPFC-依存性認知機能障害の研究を行っています。そして、大脳皮質機能障害に関わる細胞とそれらの機能変化を解明するために、mPFCの構造的可塑性についての検討を進めており、認知作業能低下と関係する神経障害性疼痛を有する雄マウスの軸索起始部の長さの変化の調査に取り組んできました(Shiers, et al. J Neurosci 2018, Shiers, et al. Neuropsychopharmacology, 201)。細胞の形態学的側面を調べることは、神経障害性疼痛における認知機能障害の原因や治療方法の手がかりを得るために重要ですが、mPFCの微細構造分析に際しては、FV3000を用いて得られる高解像画像が大変有効でした。 |
Dr. Theodore Priceからのコメント
 | 我々の研究の主な目的は、認知過程に深く関わっている脳の構造に対して、神経障害性疼痛がどのような影響を及ぼしているかを理解することです。認知機能異常が神経障害性疼痛の重要な共存疾患であることはわかっていますが、分子レベルではほとんど何もわかっていません。本研究では、マウスPFCにおいて神経障害性疼痛が引き起こす軸索起始部の微細な変化について検討しましたが、FV3000を用いることで、PFCの超微細構造の高品質画像を得ることができました。これは、神経障害性疼痛の重要な側面を理解するための画期的な手法です。 |
アプリケーションノート制作にご協力賜りました先生:
Stephanie Shiers, Ph.D. Candidate, Price Lab, University of Texas at Dallas
Theodore J. Price, Ph.D., Price Lab, Eugene McDermott Professor, Director,
Center for Advanced Pain Studies, Department of Neurobiology, School of Behavioral and Brain Sciences, University of Texas at Dallas
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。