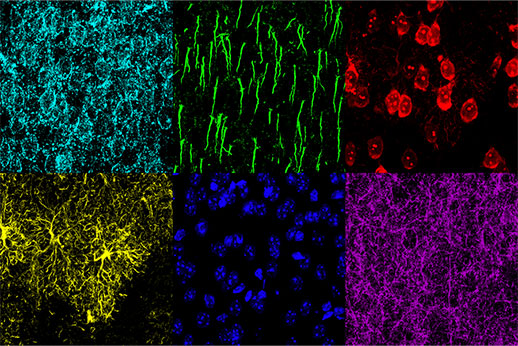
Multiplexage avec le microscope confocal FV3000
Caractérisation morphologique du cortex préfrontal interne de la souris
Pour pouvoir étudier les mécanismes de déficience cognitive, il faut être en mesure d’associer des modifications morphologiques à des réponses physiologiques. De plus, pour comprendre les effets des différents stades de la maladie et des traitements sur la morphologie cérébrale, il est important de pouvoir identifier les différentes structures morphologiques présentes dans un échantillon. Dans cette étude, un microscope confocal FV3000 muni de détecteurs TruSpectral a été utilisé avec succès pour observer six structures distinctes dans le cortex préfrontal interne de souris : les astrocytes, les neurones pyramidaux, les neurones inhibiteurs, les membranes neuronales, les segments initiaux des axones et les noyaux.
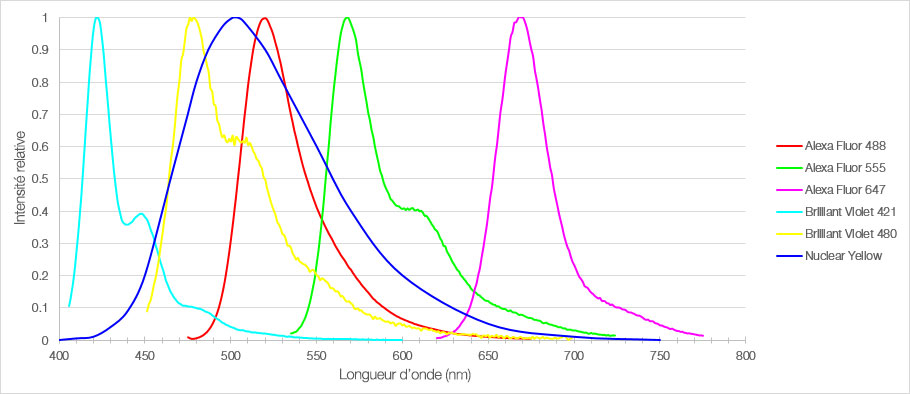
Figure 1 : Spectres d’émission des six fluorophores utilisés pour marquer les coupes de cortex préfrontal interne de souris.
Identification distincte de six structures grâce à la technologie TruSpectral
Lors de cette expérience, une coupe fixée de cortex préfrontal interne de souris de 30 µm d’épaisseur a été marquée au moyen de six fluorophores différents. Des images 3D fluorescentes du tissu cérébral multiplexé ont été acquises au moyen d’un microscope confocal FV3000 d’Olympus équipé d’un objectif UPLSAPO20X. À l’aide de la détection TruSpectral, les paramètres d’acquisition et de détection ont été définis individuellement pour chaque fluorophore afin d’optimiser la détection des signaux et d’éviter le risque d’interférences entre les spectres. Sur l’image obtenue, les signaux pour chaque fluorophore sont intenses avec des profils d’émission distincts, ce qui a permis la détection précise de plusieurs structures au sein du même échantillon.
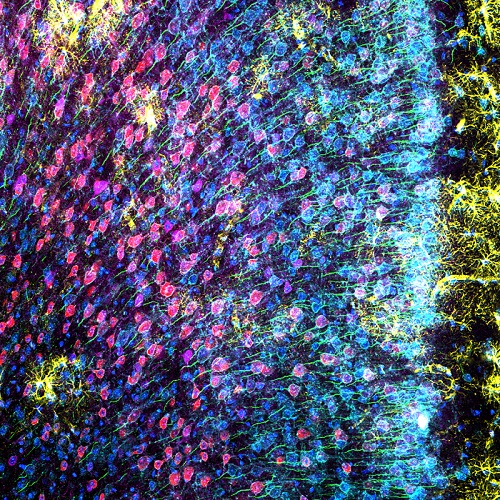
Figure 2 : Cortex préfrontal interne de souris avec marquage de GFAP (glial fibrillary acidic protein, marqueur d’astrocytes, jaune), CaMKII (calmodulin-dependent protein kinase II, marqueur de neurones pyramidaux, rouge), AMIGO-1 (amphoterin-induced protein 1 precursor, marqueur de membranes neuronales, cyan), PV (parvalbumine, marqueur de neurones inhibiteurs, violet), AnkG (ankyrine-G, marqueur de segments initiaux des axones, vert) et le colorant Nuclear Yellow (marqueur nucléaire, bleu).
Conditions d’imagerie
Microscope : Microscope confocal à balayage laser FLUOVIEW FV3000
Objectif : Objectif sans immersion 20x (UPLSAPO20X)
Lasers : 405 nm (BV421, Nuclear Yellow), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) et 640 nm (AF647)
Imagerie haute résolution de structures morphologiques distinctes avec l’objectif 100x à immersion
Afin d’obtenir des images de résolution supérieure, une région du cortex préfrontal interne de souris exprimant les six marqueurs a été visualisée avec l’objectif 100x à immersion dans l’huile de silicone associé aux détecteurs à haute sensibilité TruSpectral. Les images obtenues présentent des signaux intenses et détaillés. La superposition des signaux a permis aux chercheurs d’observer clairement la morphologie des différentes populations de neurones au sein du cortex préfrontal interne.
(A) | (B) |
Figure 3 : Cortex préfrontal interne de souris avec marquage de GFAP (glial fibrillary acidic protein, marqueur d’astrocytes, jaune), CaMKII (calmodulin-dependent protein kinase II, marqueur de neurones pyramidaux, rouge), AMIGO-1 (amphoterin-induced protein 1 precursor, marqueur de membranes neuronales, cyan), PV (parvalbumine, marqueur de neurones inhibiteurs, violet), AnkG (ankyrine-G, marqueur de segments initiaux des axones, vert) et le colorant Nuclear Yellow (marqueur nucléaire, bleu). (A) Canaux individuels pour chacun des six fluorophores. (B) Images superposées.
Conditions d’imagerie
Microscope : Microscope confocal à balayage laser FLUOVIEW FV3000
Objectif : Objectif à immersion dans l’huile de silicone 100x (UPLSAPO20X)
Lasers : 405 nm (BV421, Nuclear Yellow), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) et 640 nm (AF647)
L’apport du microscope confocal FV3000 pour notre expérience
Le système entièrement spectral avec détecteurs GaAsP haute efficacité offre la grande sensibilité nécessaire à l’imagerie multiplexe
| La technologie de détection TruSpectral présente sur tous les microscopes confocaux FV3000 améliore le rendement lumineux par rapport aux microscopes à détection spectrale classiques. L’efficacité de transmission des réseaux de diffraction holographique en phase volumique est jusqu’à trois fois plus élevée que les réseaux de réflexion. Grâce au détecteur spectral haute sensibilité (HSD) du microscope FV3000, les signaux intenses et les signaux faibles peuvent être séparés de façon optimale par le réglage indépendant de la sensibilité de chaque détecteur TruSpectral. De plus, l’algorithme de déconvolution spectrale du système FV3000 permet de séparer les spectres qui se chevauchent à partir des informations spectrales provenant des images de la pile lambda. Les interférences de fluorescence entre les canaux peuvent être éliminées par l’algorithme de démixage pendant l’acquisition d’images en direct et lors du post-traitement, pour une séparation nette de jusqu’à seize fluorophores. | Related Videos |
L’objectif à immersion dans l’huile de silicone UPLSAPO100XS crée des images lumineuses de tissus épais
Les objectifs super apochromatiques UPLSAPO compensent à la fois les aberrations sphériques et chromatiques et présentent une transmission élevée sur une plage s’étendant du visible jusqu’au proche infrarouge. L’indice de réfraction de l’huile de silicone (n≈1,40) est proche de celui du tissu vivant (n≈1,38), ce qui permet d’effectuer des observations haute résolution en profondeur dans un tissu vivant avec une très faible aberration sphérique et une morphologie 3D précise.
 | Grossissement : 100X Ouverture numérique : 1,35 (immersion dans l’huile de silicone) Distance de travail : 0,2 mm Niveau de correction de l’aberration chromatique : super apochromatique (SAPO) |
Utilisation du microscope FV3000 pour caractériser les mécanismes moléculaires de la douleur neuropathique dans le cerveau
Commentaire de Stephanie Shiers
 | Nos travaux portent sur les troubles cognitifs dans le cortex préfrontal interne en cas de douleur neuropathique. Nous étudions la plasticité structurale du cortex préfrontal interne pour déterminer quels types cellulaires sont impliqués dans le dysfonctionnement cortical et comprendre les modifications fonctionnelles associées. Nous avons mis en évidence une réduction de la longueur des segments initiaux des axones dans le cortex préfrontal interne chez des souris mâles souffrant de douleur neuropathique. Cette réduction de longueur est corrélée avec une baisse des performances lors d’un test cognitif (Shiers, et al. J Neurosci 2018, Shiers, et al. Neuropsychopharmacology, 2019). Grâce à ces données morphologiques, nous sommes en mesure de proposer des hypothèses sur l’origine du dysfonctionnement cognitif associé à la douleur et sur la façon de le traiter. L’imagerie haute résolution avec le microscope FV3000 a eu une importance cruciale pour nos analyses de la microarchitecture du cortex préfrontal interne. |
Commentaire de Theodore Price
 | L’un des principaux objectifs de notre recherche est de comprendre comment la douleur neuropathique affecte les structures cérébrales qui sont intimement impliquées dans le traitement cognitif. Nous savons que les problèmes cognitifs constituent une comorbidité importante de la douleur neuropathique, mais nous en savons peu sur les mécanismes moléculaires sous-jacents. Nos travaux sur le cortex préfrontal de souris ont révélé des modifications subtiles des segments initiaux des axones en cas de douleur neuropathique. Les images de la plus haute qualité de l’ultrastructure du cortex préfrontal obtenues avec le microscope FV3000 nous ont ouvert de nouvelles voies pour comprendre cet aspect important de la douleur neuropathique. |
Remerciements
Cette note d’application a été rédigée avec l’aide des chercheurs suivants :
Stephanie Shiers, doctorante, Price Lab, Université du Texas à Dallas
Theodore J. Price, Ph. D., Price Lab, professorat Eugene McDermott, directeur,
Center for Advanced Pain Studies, Department of Neurobiology, School of Behavioral and Brain Sciences, Université du Texas à Dallas
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.