Multiplexação com o microscópio confocal FV3000
Caracterizando a morfologia do córtex pré-frontal medial de camundongo
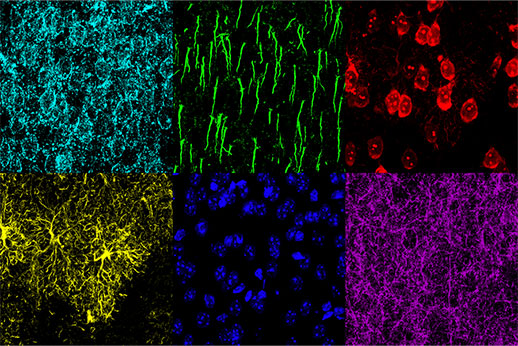
O estudo dos mecanismos de comprometimento cognitivo requer o recurso de associação de alterações morfológicas a respostas fisiológicas. Para entender como os estados e tratamentos das doenças se relacionam e afetam a morfologia cerebral, é importante poder identificar várias estruturas morfológicas dentro da mesma amostra. Neste estudo, o microscópio confocal FV3000 com detectores TruSpectral foi usado para capturar com sucesso seis estruturas diferentes no córtex pré-frontal medial de camundongo (mPFC): astrócitos, neurônios piramidais, neurônios inibidores, membranas neuronais, segmentos iniciais do axônio e núcleos.
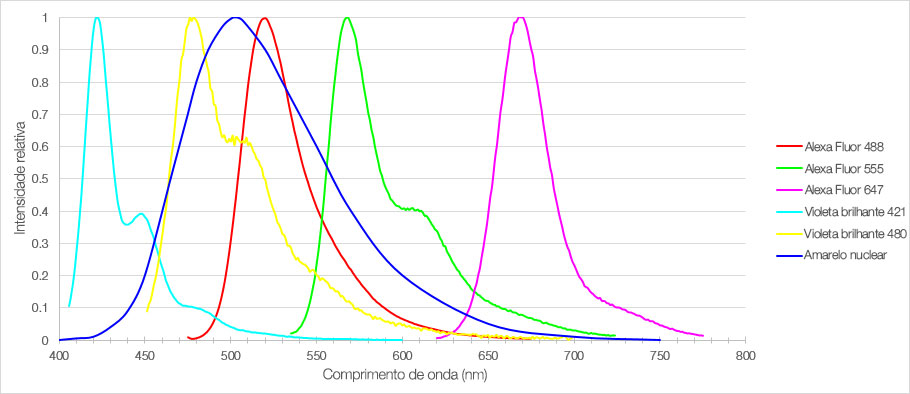
Figura 1: Espectros de emissão dos seis fluoróforos usados para marcar seções do córtex pré-frontal medial do camundongo.
A tecnologia TruSpectral permite a identificação distinta de seis estruturas
Neste experimento, uma seção fixa de 30 µm de espessura do córtex pré-frontal medial do camundongo foi marcada com seis fluoróforos diferentes. Um microscópio confocal Olympus FV3000 equipado com uma objetiva UPLSAPO20X capturou imagens fluorescentes 3D do tecido cerebral multiplexado. Usando a detecção TruSpectral, os parâmetros individuais de aquisição e detecção foram definidos para cada fluoróforo para otimizar a detecção do sinal e impedir o sangramento. A imagem resultante reproduziu sinais brilhantes de cada fluoróforo com perfis de emissão distintos, permitindo a detecção precisa de várias estruturas dentro da mesma amostra.
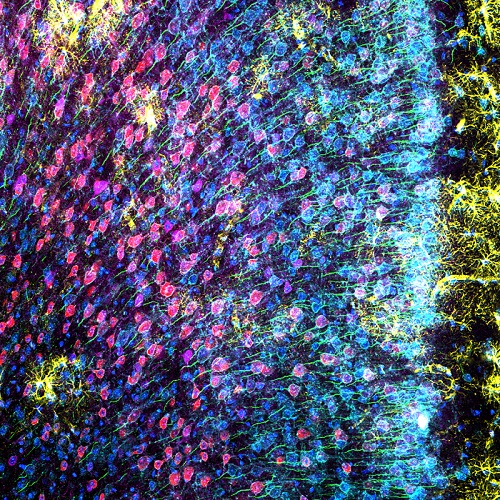
Figura 2: mPFC de camundongo marcado com proteína ácida fibrilar glial (GFAP; marcador de astrócitos; amarelo), proteína quinase II dependente de calmodulina (CaMKII; marcador de neurônio piramidal; vermelho), precursor da proteína 1 induzida por anfoterina (AMIGO-1; marcador de membrana neuronal; ciano), parvalbumina (PV; marcador inibidor dos neurônios; roxo), anquirina-G (AnkG; marcador do segmento inicial do axônio; verde) e amarelo nuclear (marcador dos núcleos; azul).
Condições de imagem
Microscópio: microscópio confocal de varredura a laser FLUOVIEW FV3000
Objetiva: objetiva seca de 20X (UPLSAPO20X)
Lasers: 405 nm (BV421, amarelo nuclear), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) e 640 nm (AF647)
A objetiva de óleo de silicone 100X permite imagens de alta resolução de estruturas morfológicas distintas
Para obter imagens de resolução mais alta do mPFC do camundongo, a objetiva de óleo de silicone 100X foi usada com os detectores de alta sensibilidade TruSpectral para obter imagens detalhadas e brilhantes de uma região do córtex que exibia todos os seis marcadores. Essa combinação permitiu que os pesquisadores observassem claramente a morfologia das diferentes populações de neurônios no córtex pré-frontal medial.
(A) | (B) |
Figura 3: mPFC de camundongo marcado com proteína ácida fibrilar glial (GFAP; marcador de astrócitos; amarelo), proteína quinase II dependente de calmodulina (CaMKII; marcador de neurônio piramidal; vermelho), precursor da proteína 1 induzida por anfoterina (AMIGO-1; marcador de membrana neuronal; ciano), parvalbumina (PV; marcador inibidor dos neurônios; roxo), anquirina-G (AnkG; marcador do segmento inicial do axônio; verde) e amarelo nuclear (marcador dos núcleos; azul). (A) Canais individuais dos seis fluoróforos. (B) Imagem de sobreposição.
Condições de imagem
Microscópio: microscópio confocal de varredura a laser FLUOVIEW FV3000
Objetiva: objetiva de óleo de silicone 100X (UPLSAPO100XS)
Lasers: 405 nm (BV421, amarelo nuclear), 445 nm (BV480), 488 nm (AF488), 561 nm (AF555) e 640 nm (AF647)
Como o microscópio confocal FV3000 facilitou nosso experimento
O sistema totalmente espectral com detectores GaAsP de alta eficiência fornece alta sensibilidade para geração de imagens multiplex
| Integrada em todos os microscópios confocais FV3000, a tecnologia de detecção TruSpectral permite maior rendimento de luz em comparação com as unidades de detecção espectral convencionais. O holograma em fase de volume difrata a luz com eficiência de transmissão três vezes maior em comparação com as grades de reflexão. Com o detector espectral de alta sensibilidade (HSD) do microscópio FV3000, os sinais luminosos e escuros podem ser bem separados, com ajuste independente de sensibilidade de cada detector TruSpectral. Além disso, o algoritmo de deconvolução espectral do sistema FV3000 permite que os espectros sobrepostos sejam separados com base nas informações espectrais das imagens de lamba stack. O cross-talk de fluorescência entre canais pode ser eliminada pelo unmixing algoritmo durante a aquisição de imagens ao vivo e o pós-processamento, permitindo uma separação limpa de até dezesseis fluoróforos. | Vídeos relacionados |
Objetiva de imersão em óleo de silicone UPLSAPO100XS para imagens brilhantes de tecidos espessos
As objetivas super apocromáticas UPLSAPO compensam as aberrações esféricas e cromáticas, e têm alta transmissão da região visível para a região infravermelha próxima. O índice de refração do óleo de silicone (ne≈1.40) é semelhante ao do tecido vivo (ne≈1.38), permitindo observações de alta resolução nas profundezas do tecido vivo com aberração esférica mínima e morfologia 3D precisa.
|
Aumento: 100X
AN: 1,35 (imersão em óleo de silicone) D.T.: 0,2 mm Nível de correção da aberração cromática: super apocromática (SAPO) |
Usando o microscópio FV3000 para pesquisar os impactos da dor neuropática no cérebro em nível molecular
Comentários de Stephanie Shiers
 | Nosso trabalho concentra-se no comprometimento cognitivo dependente do córtex pré-frontal medial (mPFC) na dor neuropática. Investigamos a plasticidade estrutural no mPFC para elucidar os tipos de células envolvidas na disfunção cortical e obter informações sobre as alterações funcionais dessas células. Observamos uma redução no comprimento dos segmentos iniciais do axônio (AIS) no mPFC de camundongos machos com dor neuropática que se correlaciona com o baixo desempenho em uma tarefa cognitiva (Shiers et al., J. Neurosci 2018, Shiers et al. 2019). A compreensão da morfologia desses tipos de células nos dá pistas sobre o que é subjacente à disfunção cognitiva na dor e como podemos tratá-la. As imagens de alta resolução fornecidas pelo microscópio FV3000 foram fundamentais para nossas análises da microarquitetura mPFC. |
Comentários do Dr. Theodore Price
 | O objetivo principal de nossa pesquisa é entender como a dor neuropática afeta as estruturas cerebrais que estão intimamente envolvidas no processamento cognitivo. Sabemos que os problemas cognitivos são uma comorbidade importante da dor neuropática, mas sabemos pouco sobre os fundamentos moleculares. Nosso trabalho no PFC do camundongo revelou boas alterações no AIS causadas por dor neuropática. A capacidade de obter imagens da mais alta qualidade da ultraestrutura do PFC com o microscópio FV3000 abriu novas maneiras de entender esse importante aspecto da dor neuropática. |
Agradecimentos
Esta nota de aplicação foi preparada com a ajuda dos seguintes pesquisadores:
Stephanie Shiers, Ph.D. Candidate, Price Lab, Universidade do Texas, em Dallas
Theodore J. Price, Ph.D., Price Lab, Eugene McDermott Professor, Diretor,
Centro de Estudos Avançados da Dor, Departamento de Neurobiologia, Escola de Ciências do Comportamento e do Cérebro, Universidade do Texas em Dallas
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.