Évaluation de l’efficacité des médicaments par l’imagerie de la réponse aux médicaments
Sommaire
- Imagerie de la réponse de sphéroïdes à un médicament (fluctuation de la concentration en ions calcium)
- Observation multipoint de plaques multipuits contenant des cellules marquées par chimioluminescence
- Observation de longue durée de cellules marquées à la luciférase grâce à la perfusion du milieu et à l’ajout automatisé du substrat
- Observation de l’embryogenèse de la drosophile
1. Imagerie de la réponse de sphéroïdes à un médicament (fluctuation de la teneur en ions calcium)
Les organoïdes et les sphéroïdes (agrégats de cellules) sont des modèles 3D dont la réponse aux médicaments ressemble davantage à celle des tissus in vivo que celle des cellules cultivées en 2D qui sont généralement utilisées pour l’évaluation des effets des agents thérapeutiques in vitro. Il y a donc un besoin croissant en organoïdes et en sphéroïdes dans la recherche pharmaceutique pour évaluer l’efficacité des médicaments. Par ailleurs, l’imagerie de luminescence, qui implique l’utilisation de protéines luminescentes plutôt que de protéines fluorescentes, suscite de plus en plus d’intérêt en raison d’avantages comme une phototoxicité réduite et l’absence de bruit de fond de fluorescence.
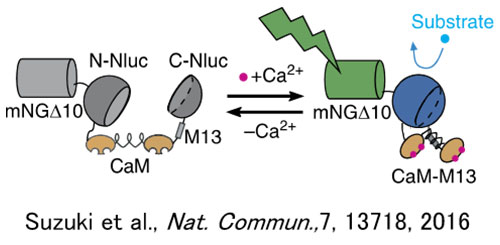
Pour l’étude des ligands des récepteurs couplés aux protéines G (GPCR), qui sont l’un des groupes moléculaires à fort potentiel pharmaceutique, les fluctuations de la concentration en ions calcium sont souvent utilisées comme indicateur. Comme la chimioluminescence (CL) ne nécessite pas de lumière d’excitation – contrairement à la fluorescence –, l’autofluorescence des sphéroïdes et des autres structures n’est pas un problème. Grâce à cette caractéristique des sondes chimioluminescentes, il est possible d’utiliser l’imagerie de chimioluminescence pour mesurer les fluctuations de la concentration en ions calcium dans les sphéroïdes tout en maintenant un rapport signal sur bruit élevé et des quantifications très précises. Des capteurs de calcium luminescents GeNL (Ca2+)_520 (41) ont donc été introduits dans des sphéroïdes créés à partir de cellules cultivées (GeNL = green enhanced nanolantern). Après stimulation à l’histamine, qui est un ligand du récepteur GPCR H1 des sphéroïdes, on a tenté d’effectuer une observation continue à long terme des fluctuations de la concentration interne en ions calcium d’une cellule (21). On a réussi à observer les signaux lumineux du capteur GeNL(Ca2+)_520 avec un rapport signal sur bruit élevé pendant une période de 50 minutes (figure 2).
Conditions d’observation
Cellules HEK293T : cultivées pendant une semaine dans une plaque de 96 puits à fond en U ; transfection transitoire par un virus adéno-associé exprimant le capteur d’ions calcium chimioluminescent (GeNL(Ca2+)_520)
Récipient d’observation : plaque multipuits, 96 puits, fond en U
Milieu d’observation : DMEM/F-12 (Gibco) + 10 % de sérum de veau fœtal
Substrat luminescent : 10 µM de furimazine (Promega)
Stimulation cellulaire : 2 μM d’histamine
Microscope : système d’imagerie de luminescence* basé sur le système IXplore™ Live
Objectif : UPLSAPO20X (ON 0,75), adaptateur pour caméra : 0,5x
Caméra EM-CCD : Andor iXon Ultra 888 (EM-Gain 1000x), temps d’exposition : 20 secondes/photo, regroupement : 1 × 1
|
|
Figure 1 : Fonctionnement de l’actionneur du capteur d’ions calcium chimioluminescent GeNL(Ca2 )_520 (à gauche) et exemple d’un système d’imagerie de luminescence basé sur le système IXplore Live (à droite) |
Image en fond clair | Image de luminescence |
Images superposées
|
Vidéo 1 : Observation en luminescence des fluctuations de la concentration en ions calcium causées par la stimulation à l’histamine (échelle graphique : 500 µm) |
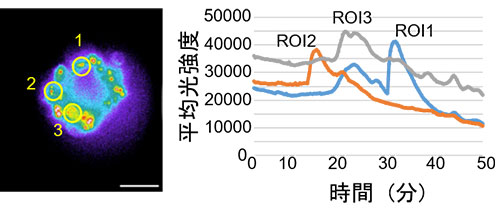
Figure 2 : Mesures des fluctuations de la concentration en ions calcium causées par la stimulation à l’histamine
2. Observation multipoint de plaques multipuits contenant des cellules marquées par chimiluminescence
Lorsqu’on crible une bibliothèque de molécules pour identifier de nouveaux médicaments candidats, il est nécessaire d’effectuer une analyse à haut contenu de cellules cultivées dans une plaque multipuits pour tester plusieurs phénotypes cellulaires, comme la concentration en ions intracellulaires et des modifications de la morphologie des cellules. Pour ces analyses, l’utilisation de protéines chimioluminescentes à haute luminosité s’avère particulièrement efficace, car elle permet d’obtenir des informations quantitatives sur les changements morphologiques et le moteur des cellules avec un fort contraste.
En vue d’utiliser l’imagerie de chimioluminescence pour le criblage de médicaments et l’évaluation de leur efficacité, nous avons ensemencé une plaque multipuits avec des cellules cultivées exprimant des protéines chimioluminescentes. Des prises de vue multipoints automatisées répétées ont été effectuées sur chaque puits à l’aide d’une platine motorisée, et une analyse des données d’imagerie acquises a été effectuée pour tous les puits. Cela a permis l’acquisition d’images de l’ensemble de la plaque multipuits en quelques minutes seulement. Nous avons ainsi réussi à observer des images à faible grossissement des puits de la microplaque ainsi que des images à fort grossissement de la morphologie des cellules individuelles avec un contraste élevé. Les images des cellules avec des champs d’observation allant de 1 mm à 100 µm sont présentées dans la figure 3. Notre expérience montre que l’analyse cellulaire à haut débit et à haut contenu peut être réalisée à l’aide d’un système d’imagerie de chimioluminescence incorporant un microscope capable d’effectuer des prises de vue multipoints.
Conditions d’observation
Cellules HeLa : expression stable du capteur Yellow-enhanced nanolantern, une protéine chimioluminescente à haute luminosité
Récipient d’observation : plaque multipuits, 96 puits, fond plat
Milieu d’observation : HBSS(-) (Sigma)
Substrat luminescent : 10 µM de furimazine (Promega)
Microscope : système d'imagerie de luminescence* basé sur le système IXplore Live
Objectif : UPLFLN10X2PH (ON 0,3), adaptateur de caméra : 0,5x
Caméra EM-CCD : Andor iXon Ultra 888 (EM-Gain 1000x), temps d'exposition : 1 seconde/photo, regroupement : 2 × 2
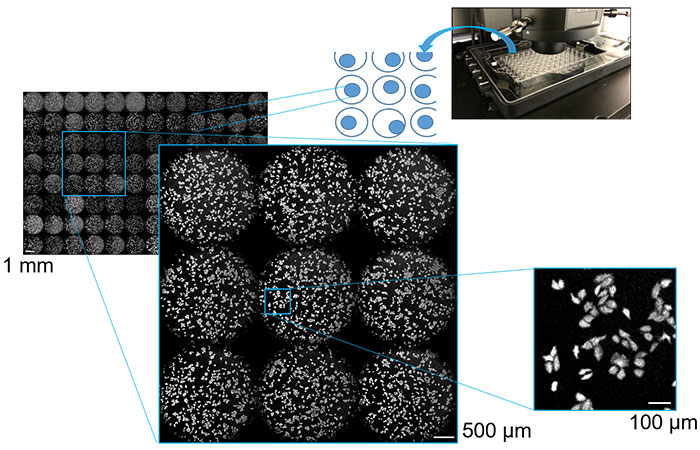
Figure 3 : Images de cellules cultivées dans des plaques multipuits (échelle de 1 mm,
500 µm et 100 µm) saisies par imagerie de luminescence avec prises de vue multipoints
3. Observation de longue durée de cellules marquées à la luciférase grâce à la perfusion du milieu et à l’ajout automatisé du substrat
Lorsqu’on évalue l’efficacité d’un médicament, il est essentiel d’observer les cellules sur une longue période afin de pouvoir faire une analyse détaillée des effets du médicament sur celles-ci. En raison de leur maturation rapide et de leur courte demi-vie, les luciférases sont depuis longtemps reconnues comme des gènes rapporteurs efficaces pour suivre la dynamique de l’expression génique au fil du temps. De plus, les luciférases étant des sondes luminescentes et non fluorescentes, aucune lumière d’excitation n’est nécessaire, ce qui réduit la phototoxicité pour les cellules lors des applications d’imagerie à long terme. Cependant, comme elles nécessitent un substrat luminescent (luciférine), un apport stable de luciférine aux cellules est important.
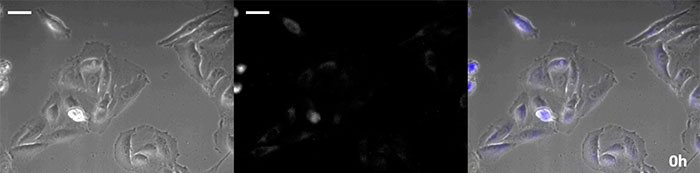
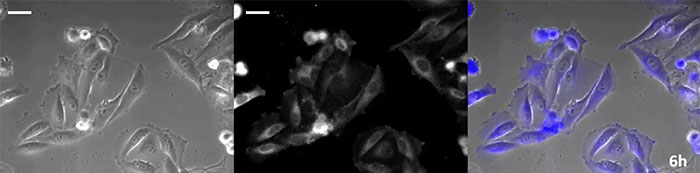
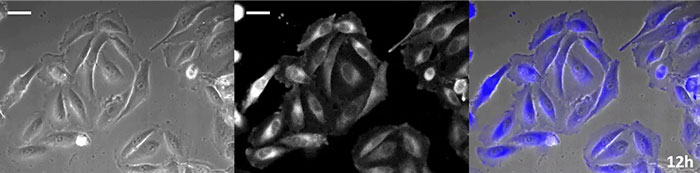
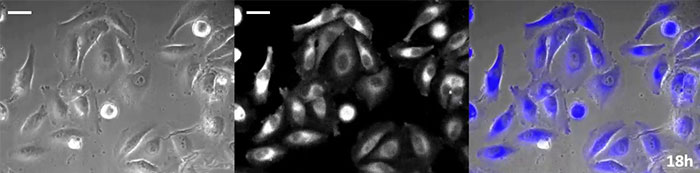
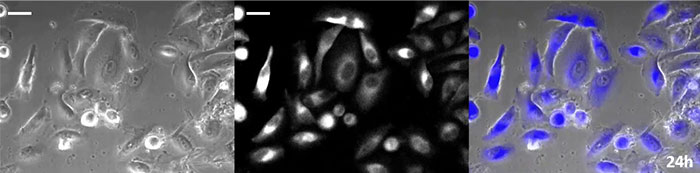
La luciférine de type coelenterazine a une luminosité particulièrement élevée, mais, comme elle s’oxyde assez rapidement dans la cellule, il est nécessaire d’en ajouter régulièrement lors des observations de longue durée. Pour résoudre ce problème, nous avons perfusé des cellules exprimant une protéine luminescente de haute intensité avec du milieu de culture tandis qu’un dispositif d’ajout de substrat automatisé ajoutait automatiquement de la coelentérazine afin que la luminescence puisse être suivie en continu. Nous avons ainsi réussi à suivre les effets d’un médicament en prenant des images de la luminescence en combinaison avec des images en contraste de phase pendant plus de 24 heures (figure 4).
Image en contraste de phase | Image de luminescence |
Image de superposition
|
0 heure |
|
6 heures |
|
12 heures |
|
18 heures |
|
24 heures |
|
Conditions d’observation
Cellules HeLa† : expression stable de la protéine de chimiluminescence à haute luminosité, nano-lanterne améliorée jaune
Récipient d’observation : boîte de Pétri à fond en verre de 35 mm
Milieu d’observation : DMEM/F12 (Gibco) + 10 % de sérum de veau fœtal
Substrat luminescent : 2,5 mM de coelenterazine-h (FUJIFILM Wako Pure Chemical Corp.), 1,2 µL/7,5 minutes
Débit de perfusion : 40 µL/minute, drainage moyen : env. 10 ml/heure
Microscope : système d’imagerie de luminescence* basé sur le système IXplore Live
Objectif : UPLFLN40XPH (ON 0,75), adaptateur de caméra : 0,5x
Caméra EM-CCD : Andor iXon Ultra 888 (EM-Gain 1000x), temps d’exposition : 5 minutes/photo, intervalle de prise de vue : 7,5 minutes, regroupement : 1 × 1
4. Observation de l’embryogenèse de la drosophile
L’évaluation de l’efficacité des médicaments sur des organismes modèles est essentielle pour passer à l’étape suivante des essais cliniques sur l’homme. Ces dernières années, la drosophile a attiré l’attention en tant qu’excellent modèle pour la recherche sur les maladies humaines. Par exemple, le vandetanib, un médicament qui a été découvert grâce au développement et à l’utilisation d’un modèle de cancer médullaire de la thyroïde chez la drosophile, a été approuvé par la FDA comme traitement pour l’homme.
Bien que les protéines fluorescentes soient souvent utilisées comme rapporteurs pour suivre l’expression de gènes chez des organismes modèles vivants, divers problèmes doivent être pris en compte, notamment la transmission de la lumière par les embryons et l’autofluorescence en réponse à la lumière d’excitation. L’imagerie de luminescence, quant à elle, ne nécessite pas de lumière d’excitation, ce qui élimine la majorité de ces problèmes. Pour cette expérience, des larves de drosophile de troisième stade, dont le gène de la protéine Engrailed a été fusionné au gène de la luciférase utilisé comme rapporteur, ont été nourries avec un mélange de D-luciférine et de pâte de levure, pour suivre les changements de l’expression du gène Engrailed lors du processus d’embryogenèse de la drosophile. Les résultats ont montré que la luminescence pouvait être détectée profondément à l’intérieur de la chrysalide, à travers la coquille pupale, et nous avons réussi à observer en temps réel les changements niveau d’expression et de localisation de l’expression du gène Engrailed au cours du processus de transformation (vidéo 2).
Image de luminescence | Image de luminescence (pseudo-couleur) |
 |
Vidéo 2 : Imagerie de luminescence d’un embryon de drosophile (échelle graphique : 500 µm)
Conditions d’observation
Drosophile : rapporteur luminescent (luciférase : Pmat) de l’expression du gène Engrailed
Après avoir nourri des larves de drosophile de troisième stade avec un mélange de D-luciférine et de pâte de levure, les pupes ont été placées dans une plaque de 24 puits pour l’observation.
Microscope : système d’imagerie de luminescence* basé sur le système IXplore Live
Objectif : UPLFLN4XPH (ON 0,13), adaptateur de caméra : 0,5x
Caméra EM-CCD : Andor iXon Ultra 888 (EM-Gain 300x), temps d’exposition : 120 secondes/photo, regroupement : 1 × 1
Mentions spéciales
Ces notes d’application ont été préparées avec l’aide des chercheurs suivants :
Professeur Kenji Nagai et professeur assistant Mitsuru Hattori
Osaka University Institute of Scientific and Industrial Research, Nagai Laboratory
Les embryons de drosophiles ont été préparés avec l’aide des chercheurs suivants :
Professeur Toshie Kai et professeur assistant Ritsuko Sugiyama
Graduate School of Frontier Biosciences Osaka University, Reproductive Biology Lab
* Le système d’imagerie de luminescence utilisé pour ces expériences est le résultat d’un développement conjoint réalisé par le professeur Kenji Nagai et al. de l’Institute of Science and Technology à la Osaka University, par Tokai Hit Co. Ltd. et par Olympus Corporation dans le cadre d’un programme de développement d’équipements et de technologies de mesure et d’analyse perfectionnés. Ce système combine des composants de produits existants, notamment le microscope IXplore Live d’Olympus. Bien que ce système particulier ne soit disponible que dans certaines régions, Evident Life Sciences propose des solutions de luminescence similaires à ses clients de partout dans le monde. Contactez le représentant commercial Evident de votre région pour obtenir plus de détails.
Articles cités :
Biochemistry and Biophysics Reports, vol. 23, 2020, 100771
† Remarque : Les cellules HeLa sont l’une des souches cellulaires les plus importantes et les mieux caractérisées pour la recherche médicale et le développement scientifique. Elles ont contribué à de grandes découvertes dans les domaines de l’immunologie, des maladies infectieuses et de la recherche sur le cancer, et ont soulevé de sérieuses questions sur l’éthique dans le domaine médical. Rendez-vous sur le site http ://henriettalacksfoundation.org/ pour obtenir de plus amples renseignements sur la vie d’Henrietta Lacks et sur ses contributions à la médecine moderne.
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.