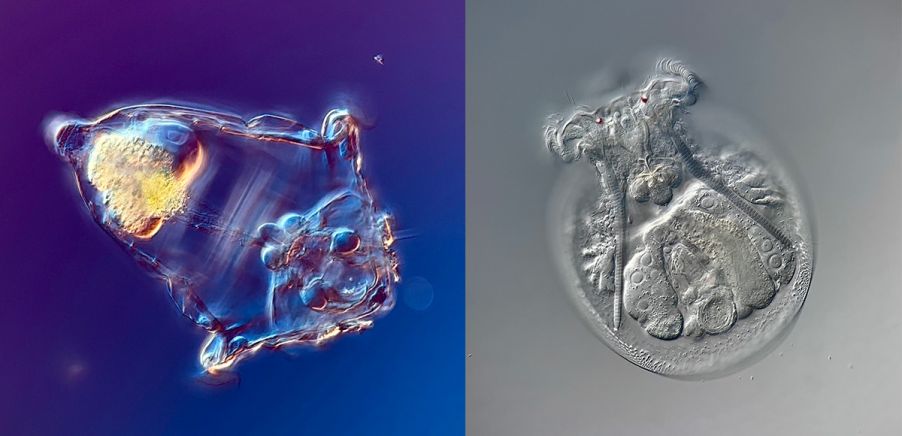
Les rotifères, du latin « rota » (« roue »), sont des animaux aquatiques microscopiques appartenant à l’embranchement des Rotifera. Ils tirent leur nom des couronnes de cils situées sur leur tête, une structure caractéristique utilisée à la fois pour se déplacer et collecter des particules de nourriture.
La couronne est constituée de cils qui tourbillonnent et donnent l’illusion de roues qui tournent, d’où leur nom.
Comptant plus de 2000 espèces différentes, les rotifères sont présents dans le monde entier. Les rotifères vivent principalement dans des habitats d’eau douce tels que les étangs et les lacs. On en trouve également dans les mousses, les lichens, les sols, les eaux usées, les milieux marins, le pergélisol et même à l’intérieur ou à l’extérieur d’autres animaux.

Collecte d’échantillons de rotifères en vue de les observer au microscope. Images reproduites avec l’aimable autorisation de Chloé Savard.
Bien que quelques espèces de rotifères soient parasites, la plupart vivent librement et nagent parmi le plancton, rampent dans les sédiments, se fixent aux plantes aquatiques submergées ou vivent à l’intérieur d’un tube gélatineux qu’ils secrètent. Ces minuscules invertébrés forment un groupe extrêmement diversifié qui a développé différentes morphologies et stratégies de locomotion pour s’adapter aux diverses pressions environnementales, y compris la prédation.
Biologie générale des rotifères
Les rotifères sont-ils unicellulaires ou pluricellulaires ? À première vue, les rotifères ressemblent à des micro-organismes unicellulaires. En réalité, bien qu’ils soient plus petits que de nombreux protozoaires unicellulaires, ils sont constitués de quelque 1000 cellules.
Si les rotifères peuvent atteindre jusqu’à 2 mm, ils mesurent généralement 0,1 à 0,5 mm de long. Les plus petits rotifères qui existent ne font que six fois la taille d’un globule rouge humain, soit 0,006 à 0,008 mm (6-8 µm) environ.

Image d’un rotifère de l’espèce Euchlanis prise avec un microscope à contraste interférentiel différentiel (CID).
Image reproduite avec l’aimable autorisation de Chloé Savard.
Si les rotifères présentent une grande variété de morphologies, ils partagent les mêmes principales régions corporelles : une tête (couronne), un corps (tronc) et un pied. Lorsqu’il est présent, le pied peut être doté d’orteils séparés (généralement deux). Certaines espèces de rotifères peuvent avoir jusqu’à quatre orteils, tandis que d’autres n’en ont aucun.
Selon l’espèce, le pied peut s’étendre de manière télescopique. Ce phénomène s’observe surtout chez les rotifères bdelloïdes, mais aussi chez l’espèce Rotaria neptunia. Le pied peut également posséder des glandes pédieuses qui sécrètent une substance collante. Les rotifères utilisent cette substance comme adhésif pour se fixer temporairement à différents substrats, tels que des plantes, des rochers, des morceaux de bois et des animaux.
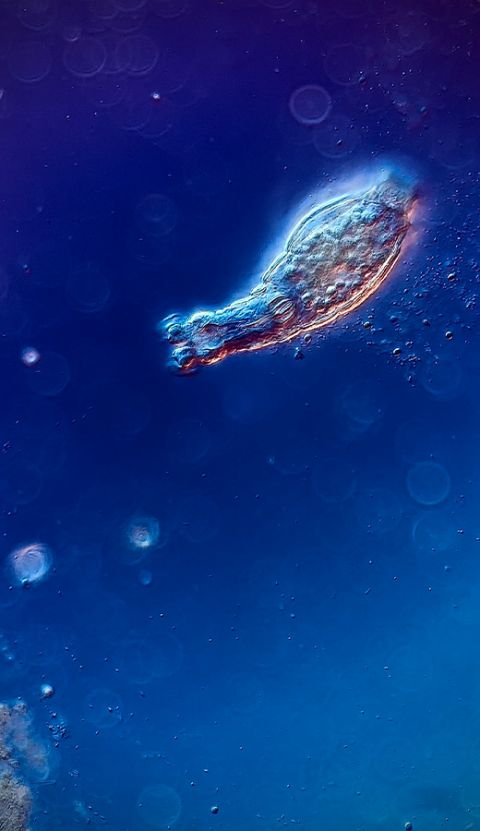
Image d’un rotifère bdelloïde prise avec un microscope à CID à 200X. Image reproduite avec l’aimable autorisation de Chloé Savard.
La plupart des espèces de rotifères planctoniques qui nagent librement ne présentent pas de pied. Certains rotifères sont strictement sessiles : ils peuvent nager à l’état larvaire jusqu’à ce qu’ils trouvent le substrat idéal auquel se fixer pour le restant de leur vie. C’est notamment le cas des Stephanoceros fimbriatus.
Bien que ces créatures primitives ne possèdent pas de système circulatoire ou respiratoire, les rotifères ont un cerveau, de petits yeux rouges, un tube digestif complet et un système musculaire, un système reproducteur et un système excréteur.
Pour protéger la plupart des systèmes organiques situés à l’intérieur du tronc, les rotifères possèdent une paroi corporelle, également appelée « tégument », qui peut être soit très épaisse et dure, soit fine et souple. Les rotifères qui possèdent une carapace dure, ou « lorica », se distinguent de ceux qui ont une carapace plus souple.
Chez certains rotifères avec lorica, le tégument peut présenter des épines à l’extrémité antérieure ou postérieure qui servent de défense contre les prédateurs. Il a été démontré que certaines espèces comme Keratella et Asplanchna pouvaient produire des épines en réponse à des signaux chimiques solubles émis par des prédateurs invertébrés tels que les copépodes. Plus il y a de prédateurs dans l’environnement des rotifères Keratella, plus les signaux chimiques sont nombreux et plus ces rotifères sont susceptibles de développer des épines.
La tête des rotifères comporte une couronne avec deux anneaux ciliés qui créent un vortex utilisé pour collecter les particules alimentaires et nager dans la colonne d’eau.
À l’instar des tardigrades, les rotifères bdelloïdes ont la capacité d’entrer dans un état de dormance appelé « cryptobiose » ou, plus précisément, « anhydrobiose ». Dans cet état, ils peuvent survivre à la dessiccation, c’est-à-dire à la perte totale d’eau de leur corps, pendant de longues périodes.
Les rotifères bdelloïdes peuvent entrer en anhydrobiose pour échapper à des parasites fongiques ou pour survivre en cas de froid extrême ou d’exposition à des radiations ionisantes. Fait intéressant : dans le cadre d’une étude datée de juin 2021, un rotifère bdelloïde extrait du pergélisol arctique est sorti de son état d’anhydrobiose après avoir été emprisonné dans la glace pendant 24 000 ans !
Que mangent les rotifères ?
Aux côtés des micro-crustacés et des protistes, les rotifères forment le troisième groupe dominant du zooplancton d’eau douce. Forts de leur régime alimentaire composé de détritus organiques, de bactéries, de levures, d’algues, de petits ciliés et d’autres protozoaires, les rotifères peuvent adapter leur comportement alimentaire en fonction des conditions environnementales et de l’abondance des proies.
Certains rotifères sont même suffisamment grands pour s’attaquer à des rotifères plus petits !

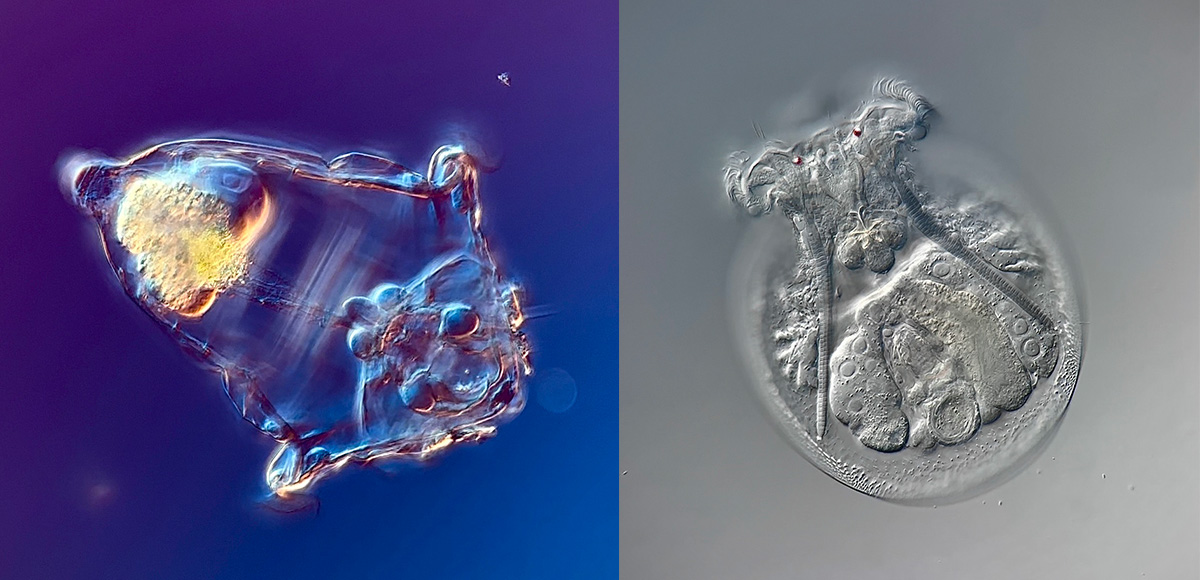
Image d’un rotifère Stephanoceros fimbriatus prise avec un microscope à CID à 100X.
Image reproduite avec l’aimable autorisation de Chloé Savard.
Grâce à leur couronne ciliée, les rotifères créent un vortex qui piège les particules de nourriture et les dirige vers leur bouche. Une fois dans la bouche, les aliments sont broyés par un pharynx modifié appelé « mastax », une caractéristique propre aux rotifères. Lorsqu’il mâche de la nourriture, le mastax ressemble à un cœur qui bat, ce qui peut être déroutant dans la mesure où les rotifères ne possèdent pas de système circulatoire.
Le mastax musculaire possède une structure en forme de mâchoire appelée trophi, qui permet de saisir, broyer et percer divers types d’aliments. La composition du trophi diffère d’une espèce à l’autre, une précieuse caractéristique favorisant l’identification des rotifères. Après avoir été broyés, les aliments quittent le mastax et descendent dans l’œsophage jusqu’à atteindre l’estomac, les intestins et pour finir l’anus, d’où ils sortent du corps.
Les rotifères peuvent également être la proie de nombreux prédateurs aquatiques tels que les protistes (en particulier les ciliés), les insectes, d’autres rotifères, les cladocères, les copépodes et les poissons. Les rotifères ont développé de nombreuses stratégies pour échapper aux prédateurs : mouvements saccadés, gaines de mucus, épines et coquilles épaissies.
Comment se reproduisent les rotifères ?
Les méthodes de reproduction des rotifères varient énormément au sein de leur embranchement. Les rotifères se reproduisent de manière sexuée ou asexuée. Dans les deux cas, ils doivent produire des œufs.
Les espèces de rotifères qui se reproduisent de manière sexuée comprennent à la fois des mâles et des femelles. Les rotifères femelles produisent des œufs mictiques, qui sont haploïdes et doivent être fécondés par le spermatozoïde d’un mâle. Si ces œufs ne sont pas fécondés, ils se développent par parthénogenèse en mâles. Les espèces planctoniques se reproduisant de manière sexuée se caractérisent souvent par un dimorphisme sexuel : les rotifères mâles ne possèdent pas de pied, sont plus petits et nagent plus vite que les rotifères femelles.
De leur côté, les rotifères bdelloïdes se reproduisent de manière asexuée par parthénogenèse. Leurs populations se composent uniquement de femelles. De plus, leurs œufs n’ont pas besoin d’être fécondés par les spermatozoïdes d’un mâle pour donner naissance à des bébés rotifères femelles. Ces types d’œufs sont appelés amictiques et sont diploïdes.
Les rotifères bdelloïdes comptent parmi les rares groupes d’animaux à ne pas avoir de représentants masculins, à l’instar de certaines espèces de cladocères, de pucerons, d’abeilles et de fourmis. Cela fait quelque 40 millions d’années que les rotifères bdelloïdes évoluent en tant que groupe exclusivement féminin !
Comment observer les rotifères au microscope ?
Les rotifères sont présents presque partout. Si vous prélevez des échantillons dans un étang, un lac ou même dans les gouttières de votre bâtiment, il est certain que vous y trouverez au moins une espèce de rotifère à observer au microscope.

Collecte d’échantillons de rotifères en vue de les observer au microscope. Images reproduites avec l’aimable autorisation de Chloé Savard.
Les rotifères bdelloïdes sont particulièrement abondants dans les mousses et les lichens. Comme ils sont sans doute dans un état de dormance, il convient de laisser tremper la mousse ou le lichen pendant 24 heures avant d’en extraire l’eau et de placer la boîte de Petri sous le microscope.
Les rotifères bdelloïdes rampent souvent au lieu de nager, si bien que ceux qui n’en ont jamais vu peuvent les confondre avec un ver (ce qui fut mon cas la première fois que j’en ai rencontré un). Afin d’assurer des conditions optimales d’observation des rotifères, utilisez un éclairage en fond clair ou noir sur un microscope composé.
Références bibliographiques et autres lectures
Allen, A. A. (1968). « Morphology of the planktonic rotifer Polyarthra vulgaris ». Transactions of the American Microscopical Society, 60-69.
Bogdan, K. G., & Gilbert, J. J. (1982). « Seasonal patterns of feeding by natural populations of Keratella, Polyarthra, and Bosmina: Clearance rates, selectivities, and contributions to community grazing » 1. Limnology and Oceanography, 27(5), 918-934.
De Paggi, S. B. J., Wallace, R., Fontaneto, D., & Marinone, M. C. (2020). « Phylum Rotifera ». Thorp and Covich’s Freshwater Invertebrates, 145–200.
Gladyshev, E., & Meselson, M. (2008). « Extreme resistance of bdelloid rotifers to ionizing radiation ». Proceedings of the National Academy of Sciences, 105(13), 5139-5144.
Gribble, K. E., & Snell, T. W. (2018). « Rotifers as a Model for the Biology of Aging ». Conn’s Handbook of Models for Human Aging, 483–495.
Hickman, C. P., Roberts, L. S., Larson, A., Ober, W. C., & Garrison, C. (2015). « Animal diversity ». WC Brown. 183.
Ricci, C. (1998). « Anhydrobiotic capabilities of bdelloid rotifers ». Hydrobiologia, 387, 321-326.
Segers, H., & De Smet, W. H. (2007). « Diversity and endemism in Rotifera: a review, and Keratella Bory de St Vincent ». Protist Diversity and Geographical Distribution, 69-82.
Shmakova, L., Malavin, S., Iakovenko, N., Vishnivetskaya, T., Shain, D., Plewka, M., & Rivkina, E. (2021). « A living bdelloid rotifer from 24,000-year-old Arctic permafrost ». Current Biology, 31(11), R712-R713.
Taylor, R. A. J. (2019). « Other invertebrates ». Taylor’s Power Law, 305–326.
Wallace, R. L. (2002). « Rotifers: exquisite metazoans ». Integrative and Comparative Biology, 42(3), 660-667.
Wallace, R. L., Snell, T. W., Walsh, E. J., Sarma, S. S. S., & Segers, H. (2019). « Phylum Rotifera ». Thorp and Covich’s Freshwater Invertebrates, 219–267.
Welch, D. B. M., & Meselson, M. (2000). « Evidence for the evolution of bdelloid rotifers without sexual reproduction or genetic exchange ». Science, 288(5469), 1211-1215.
Wininger, J. D. (2004). « Parthenogenetic Stem Cells ». Handbook of Stem Cells, 635–637.
Contenu connexe
Avalon trouve le microscope de ses rêves pour étudier les rotifères
Les étoiles du spectacle : nos images de microscopie les plus populaires de juillet 2023
C’est facile d’être vert : nos images de microscopie les plus populaires de juin 2023