Zusammenhang zwischen digitalen Bilddaten und biologischen Proben
In diesem Whitepaper wird der Zusammenhang zwischen den Signalen in biologischen Proben und den digitalen Bilddaten von Mikroskopkameras erläutert. Die Kenntnis dieses Zusammenhangs ist die Voraussetzung dafür, um ideale Bildaufnahmebedingungen für Bilder und Daten von höchster Qualität festzulegen.
Grundlagen der digitalen Bildgebung
Eine Mikroskop-Monochromkamera erfasst und visualisiert das von biologischen Proben abgegebene Licht. Das von Fluoreszenzfarbstoffen oder fluoreszierenden Proteinen abgegebene Licht wird von der Mikroskopkamera erfasst und in Photoelektronen umgewandelt, sodass es als digitales Signal detektiert werden kann.
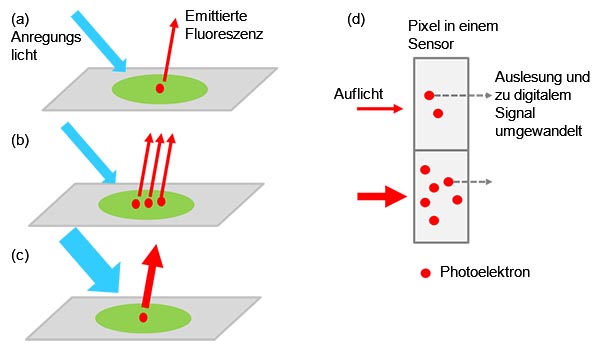
Der Signalwert ist ein komplexer Multiplikator der Anzahl der markierten Targets (z. B. Zielproteine), der Intensität des Anregungslichts und der Effizienz der Anregung und Fluoreszenzemission und -detektion, einschließlich der Effizienz der Kamera bei der Umwandlung von Licht zum digitalen Signal (Abbildung 1).
Wenn bei der Untersuchung verschiedener Proben jeweils dieselben System- und Bildaufnahmeeinstellungen verwendet werden, werden alle Komponenten, außer der Menge an Targets, zu konstanten Werten, sodass der detektierte Signalwert proportional zur Menge an Targets ist. Das bedeutet zum Beispiel, dass eine gentechnisch veränderte Probe quantitativ mit ihrem Wildtyp verglichen werden kann.
Abbildung 1: Von der Probe zum digitalen Signal - ein angeregtes markiertes Target emittiert Fluoreszenzlicht (a). |
Signal und Hintergrundrauschen
In diesem Abschnitt werden die wichtigsten Faktoren erläutert, die zur Bildqualität beitragen, und wie wichtig eine sorgfältige Bilderfassung während einer Untersuchung ist.
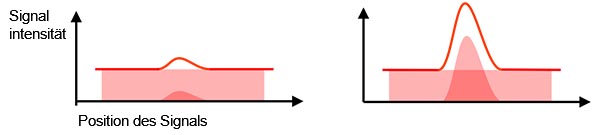
Tatsächliches Signal vs. Hintergrundsignal: Das erfasste Signal besteht aus dem tatsächlichen Signal und dem Hintergrundsignal (Hintergrundrauschen). Zur Unterscheidung des Target-Signals von Hintergrundsignalen wird ein ausreichendes hohes Verhältnis zwischen tatsächlicher Signalintensität vs. dem Hintergrundsignal benötigt (Abbildung 2). Dies wird als Signal-Rausch-Verhältnis bezeichnet. Ein höheres Signal-Rausch-Verhältnis führt zu einer besseren Bildqualität und ermöglicht quantitative Analysen.
Allgemein sind die Maximierung des tatsächlichen Signals (z. B. mit einem Objekt mit höherer numerischer Apertur (NA)) und die Minimierung der Hintergrundsignale (z. B. durch Arbeiten in einer Dunkelkammer, durch stärkere Kühlung oder durch Verwendung einer Kamera mit hoher Quanteneffizienz) gängige Methoden, um das Signal-Rausch-Verhältnis zu verbessern.
Es ist zu beachten, dass sich das Signal-Rausch-Verhältnis nicht durch die Verstärkungseinstellung verbessern lässt, da diese den Verstärkungsfaktor einer Kamera für Signale definiert und sich sowohl auf das tatsächliche Signal als auch auf das Hintergrundsignal auswirkt.
Abbildung 2: Niedriges Signal-Rausch-Verhältnis - Hintergrundrauschen erschwert die Erkennung des tatsächlichen Signals (links). |
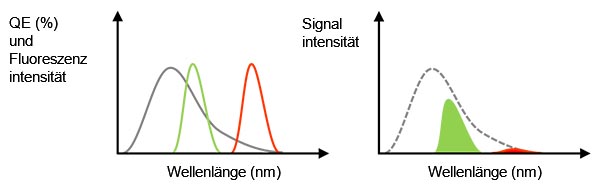
Tatsächliches Signal: Wie bereits erwähnt, kann ein Objektiv mit hoher NA das Signal-Rausch-Verhältnis verbessern. Ein anderer wichtiger Faktor zum Erhalt eines stärkeren Signals ist ein hohe Quanteneffizienz (QE). Die QE gibt den Wirkungsgrad der Umwandlung des einfallenden Lichts zu Photoelektronen an. Es ist zu beachten, dass eine Kamera kein Licht erfassen kann, wenn die QE bei einer bestimmten Wellenlänge 0 % beträgt. Es muss beispielsweise eine Kamera mit einer Empfindlichkeit über 720 nm ausgewählt werden, um Farbstoffe wie Cy7 im nahen Infrarotbereich (NIR) für ein NIR-Fenster in biologischen Geweben zu verwenden oder ein Übersprechen bei Multiplexuntersuchungen zu vermeiden.
Abbildung 3: Die graue Linie ist die QE einer Kamera. Die grüne und die rote Linie zeigen das Fluoreszenzemissionsspektrum (links).Der erfasste Signalwert entspricht der Flächengröße, die ein Multiplikator der QE und der Fluoreszenzspektren in der linken Abbildung ist (rechts). Auch wenn das Fluoreszenzlicht eine ausreichende Intensität aufweist, könnte in diesem Fall das erfasste Signal der roten Fluoreszenz aufgrund einer niedrigen QE schwach sein. |
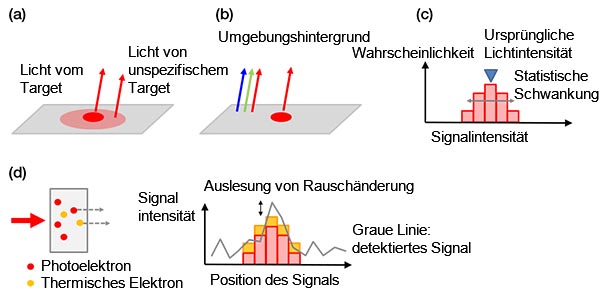
Hintergrundrauschen: Hintergrundsignale können wie folgt kategorisiert werden:
a) biologische Hintergrundsignale
b) nicht biologische Hintergrundsignale
c) statistische Fluktuationen eines Photoelektrons (Schrotrauschen)
d) Störsignale in der Kamera
Schrotrauschen ist einzigartig und ist vergleichbar mit dem Werfen einer Münze. Jeder Versuch mit der Anzahl N weist eine statistische Fluktuation von ± √ (N) auf, ähnlich wie die Wahrscheinlichkeit von 1 : 1 beim Werfen zweier Münzen (Kopf oder Zahl). Die erfasste Anzahl der Photoelektronen folgt der gleichen Regel.
Alle Beispiele zu Hintergrundrauschen sind in der folgenden Abbildung 4 gezeigt.
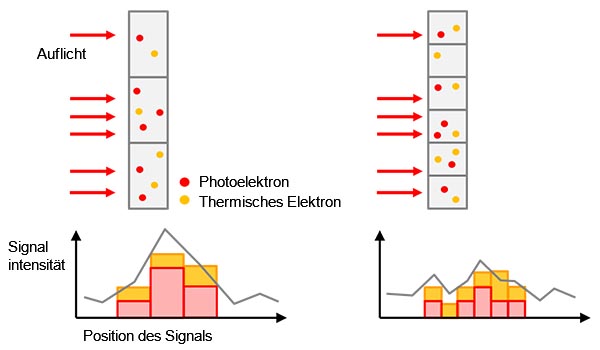
Abbildung 4: Beispiele zu Hintergrundrauschen - biologischer Hintergrund aufgrund einer unspezifischen Färbung oder Autofluoreszenz (a), Umgebungslicht aus dem Raum, das auf einem Objektträger reflektiert wird (b), Schrotrauschen (c), Störsignale in einer Kamera aufgrund thermischer Elektronen in einem Sensor (links) und ausgelesenes Rauschen (rechts) (d). Thermische Elektronen können durch Kühlung des Sensors reduziert werden. |
Auflösung: Eine größere Pixelgröße oder eine Binning-Bildaufnahme kann mehr Licht erfassen und ein höheres Signal-Rausch-Verhältnis liefern, aber die größere Pixelgröße reduziert auch die Auflösung (Abbildung 5). Es ist die beste Pixelgröße der optischen Auflösung entsprechend zu wählen.
Abbildung 5: Eine größere Pixelgröße bietet eine höhere Empfindlichkeit und eine geringere Auflösung (links). |
Praktische Empfehlungen für die Verwendung von Mikroskopkameras
Auch wenn die idealen Einstellungen für die Bildaufnahme je nach Anwendung und Probe variieren, spielen die Intensität des Anregungslichts und Belichtungszeit grundsätzlich immer eine Rolle. Eine längere Belichtungszeit oder ein stärkeres Anregungslicht erzeugt eine hellere Fluoreszenz, was zu einem höheren Signal-Rausch-Verhältnis führt, verstärkt aber die Phototoxozität. Dies wirft eine wichtige Frage auf: Wie lassen sich ideale Bildaufnahmeparameter einstellen, um längere Bildaufzeichnungen von Lebendzellen durchführen zu können und Schädigungen von Zellen aufgrund des Anregungslichts zu verringern?
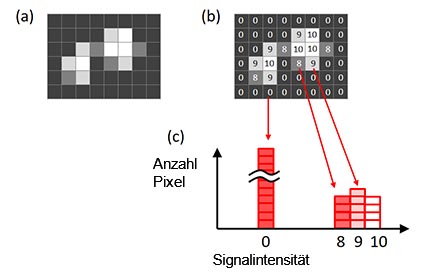
Zur Bestimmung der idealen Belichtungszeit wird ein Histogramm verwendet. Die x-Achse des Histogramms ist die Signalintensität. Die Höhe des Histogramms an jedem x-Wert zeigt die Anzahl Pixel für die Signalintensität (Abbildung 6).
Abbildung 6: Ein Histogramm eines Bilds. Ursprüngliches Bild (a), Signalintensität jedes gezeigten Pixels im Originalbild (b), |
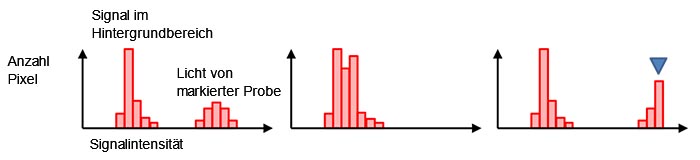
Normalerweise haben die schwarzen Hintergrundpixel auch ohne Hintergrundlicht einen digitalen Signalwert ungleich Null (Abbildung 7, links). So kann ein negativer Signalwert, der durch das in Abbildung 4 (d) erwähnte ausgelesenes Rauschen verursacht wird, vermieden werden. Form und Verteilung des Histogramms zeigen, ob die aktuelle Belichtungszeit angemessen ist. Ist das Histogramm für einen niedrigen Signalbereich zu überfüllt, ist die Belichtungszeit zu kurz (Abbildung 7, Mitte). Liegt bei maximalem Signalpegel ein steiler Abfall vor, ist der Signalwert gesättigt (Abbildung 7, rechts). In diesem Fall kann die Anregungsintensität verringert oder die Belichtungszeit verkürzt werden.
Abbildung 7: Ein Histogramm mit normaler Belichtung (links), Unterbelichtung (Mitte) |
Mitunter verfügen Bildaufnahmesoftwares über eine automatische Anzeigeanpassungsfunktion, die eine bessere Sichtbarkeit ermöglicht und die ursprünglichen Bilddaten beibehält. In den meisten Fällen ist der dynamische Bereich des Signals einer Monochromkamera (z. B. 16 Bit = 65.536 Stufen) größer als der dynamische Bereich eines Displays, der normalerweise 8 Bit (= 256 Stufen) beträgt.
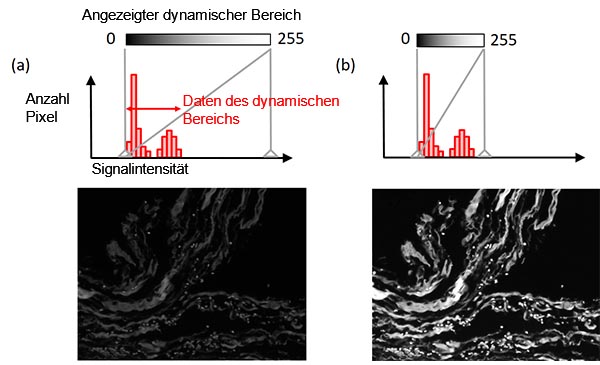
Die Anzeigeanpassungsfunktion bestimmt die Relation zwischen Signalintensität und Anzeigehelligkeit. Normalerweise ist die Intensität des hellsten Signals in der Probe viel geringer als die maximale Intensität, die die Kamera verarbeiten kann. In diesem Fall lässt sich durch Anpassung des dynamischen Anzeigebereichs an den dynamischen Datenbereich (den Bereich vom Hintergrundpegel bis zum hellsten Signal) eine bessere Sichtbarkeit erzielen, während die ursprünglichen Bilddaten beibehalten werden (Abbildung 8). Ein Histogramm dient der Veranschaulichung dieser Anpassung.
Abbildung 8: Anzeigeeinstellung - Histogramm mit dem Anzeigeeinstellungsindikator in einer grauen durchgezogenen vertikalen Linie (oben), Relation zwischen Anzeigehelligkeit und Signalintensität (Mitte) und Beispielbild (unten). Ursprüngliche Anzeigeeinstellung (links). Angepasste Anzeigeeinstellung unter Beibehaltung der ursprünglichen Bilddaten (rechts). |
Einstellung der Erfassungsparameter einer Mikroskopkamera in 6 Schritten
Zusammenfassend sind hier sechs allgemeine Schritte aufgeführt, um eine Mikroskopkamera für eine Untersuchung richtig einzustellen. Beachten Sie, dass sich die optimale Vorgehensweise nach der spezifischen Anwendung und den Proben richtet.
- Vergrößerung festlegen.
- Den Fokus auf der Probe ausrichten und das Betrachtungsziel lokalisieren. Eventuell eine höhere Verstärkung oder den Binning-Modus der Kamera verwenden, um den Prozess zu verkürzen und die Phototoxizität zu minimieren. Außerdem empfiehlt es sich, eine automatische oder manuelle Anzeigeeinstellung zu verwenden, um das Signal unter Idealbedingungen zu betrachten, und die Anregungslichtblende zu schließen, wenn das Bild nicht beobachtet wird.
- Verstärkung und Binning-Modus für die Bilderfassung festlegen.
- Zunächst mit dem schwächsten Anregungslicht starten und überprüfen, ob das Signal in einer realistischen Belichtungszeit erfasst werden kann. Kann das Signal nicht identifiziert werden oder ist das Signal-Rausch-Verhältnis zu niedrig, gegebenenfalls eine längere Belichtungszeit verwenden.
- Wenn die Belichtungszeit unrealistisch lang oder länger als die für die Bildaufnahmegeschwindigkeit maximal zulässige Belichtungszeit ist, eventuell nach und nach eine etwas höhere Anregungsintensität verwenden.
- Das Histogramm überprüfen, um sicherzustellen, dass keine Sättigung vorliegt.
Zusammenfassung
Die Bild- und Datenqualität in der Mikroskopie hängen von vielen komplexen Faktoren ab. Anhand dieser Grundlagen und Tipps zur digitalen Bildgebung ist für jede Untersuchung die beste Aufnahmeeinstellung ermittelbar. Eine Maximierung des Signals, eine Minimierung des Hintergrunds und eine Optimierung des Probenzustands sind wesentliche Elemente zur Verbesserung der Datenqualität bei jeder Anwendung und Untersuchung.
Autor
 |
Takeo Ogama
Scientific Solutions Division OLYMPUS CORPORATION OF THE AMERICAS |
Sorry, this page is not
available in your country.