Not Available in Your Country
Sorry, this page is not
available in your country.
Vue d’ensemble
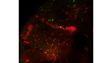
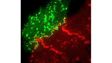
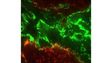
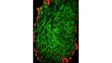
 | Excellente imagerie TIRF multicoloreConçu pour l’analyse de la dynamique membranaire, la détection monomoléculaire et les expériences de colocalisation, le système de microscope IXplore TIRF permet de produire de l’imagerie TIRF multicolore simultanée avec jusqu’à quatre couleurs et une excellente stabilité. |
|---|
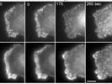
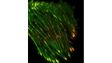
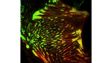
| Imagerie TIRF multicolore simultanéeLe système cellTIRF d’Olympus permet une réelle acquisition simultanée de jusqu’à quatre longueurs d’onde.
|
|---|
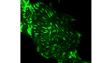
Stabilité des imagesGrâce à l’architecture de la potence et à la conception du moteur de mise au point, le système IXplore est doté d’une rigidité améliorée qui réduit l’impact des vibrations et de la température. En maintenant la position souhaitée dans l’axe Z, il permet de réaliser des prises d’images à intervalle d’une grande fiabilité. Lorsqu’il est associé au système TruFocus d’Olympus, le système de microscope IXplore TIRF peut prendre des images intermittentes d’une grande précision, correctement alignées et parfaitement nettes. | Related Videos |
| Objectifs TIRFLa microscopie de fluorescence par réflexion totale interne (TIRF) est facilitée par un large éventail d’objectifs qui assurent un rapport signal sur bruit élevé et possède une bague de correction pour compenser l’épaisseur des lamelles couvre-objet et la température. Nos objectifs planapochromatiques corrigés avec une ouverture numérique de 1,5 vous aident à acquérir des images uniformes de haute qualité avec un plus grand champ d’observation. Profitez du remarquable objectif TIRF d’Olympus avec une ouverture numérique de 1,7*, la plus grande au monde. * En date de novembre 2018, à la connaissance d’Olympus. En savoir plus sur nos objectifs à grande ouverture numérique |
|---|
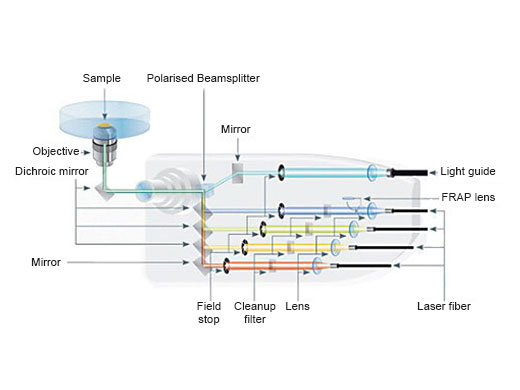
Photomanipulation précise et intuitive (périphériques en option)Le dispositif de photomanipulation cellFRAP d’Olympus et le contrôleur en temps réel (U-RTCE) permettent un contrôle précis (temps mort de 200 µs), une stimulation à diffraction limitée avec une région d’intérêt flexible et une reproduction précise des conditions expérimentales. |
|
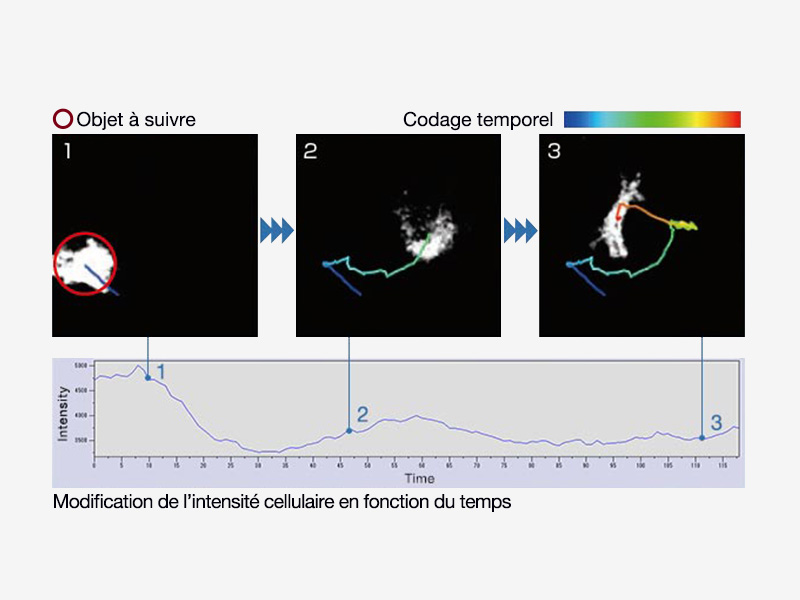 | Analyse avancéeLes fonctionnalités avancées, telles que le suivi, la numération et la mesure des objets, le kymographe et la déconvolution 2D en temps réel améliorent l’identification des objets. |
|---|
Des dispositifs rapides et précis à la microseconde prèsLa rapidité de la roue porte-filtres, de l’obturateur, de la commande de la source de lumière à DEL et des contrôleurs en temps réel (U-RTC) réduisent le photoblanchiment et la phototoxicité, ce qui préserve la viabilité des cellules et permet d’obtenir des données plus robustes. | Related Videos |
RéférencesY.Yang, et al. Spectraplakin induces positive feedback between fusogens and the actin cytoskeleton to promote cell-cell fusion. Developmental Cell (April 10, 2017). A. R. van Vliet, et al.The ER stress sensor PERK coordinates ER-plasma membrane contact site formation through interaction with filamin-A and F-actin remodeling. Molecular Cell (February 23, 2017). F. Hertel, et al. RefSOFI for mapping nanoscale organization of protein-protein interactions in living cells. Cell Reports (December 31, 2015). C. Cauvin, et al. Rab35 GTPase triggers switch-like recruitment of the lowe syndrome lipid phosphatase OCRL on newborn endosomes. Current Biology (December 24, 2015). W.-K. Ji, et al. Actin filaments target the oligomeric maturation of the dynamin GTPase Drp1 to mitochondrial fission sites. eLIFE (November 26, 2015). A. Juanes-Garcia, et al. A regulatory motif in nonmuscle myosin II-B regulates its role in migratory front–back polarity. The Journal of Cell Biology (April 13, 2015). D. Borrenberghs, et al. HIV virions as nanoscopic test tubes for probing oligomerization of the integrase enzyme. ACS Nano (March 21, 2014). S. Yamaoka, et al. Identification and dynamics of arabidopsis adaptor protein-2 complex and its involvement in floral organ development. The Plant Cell (August 23, 2013) |
Besoin d’aide ? |
Caractéristiques techniques
| Monture de microscope | IX83P2ZF | |
|---|---|---|
| Méthode d’observation > Fluorescence par réflexion interne totale | ✓ | |
| Méthode d’observation > Fluorescence (excitation bleue/verte) | ✓ | |
| Méthode d’observation > Fluorescence (excitation ultraviolette) | ✓ | |
| Méthode d’observation > Contraste interférentiel différentiel (CID) | ✓ | |
| Méthode d’observation > Contraste de phase | ✓ | |
| Méthode d’observation > Fond clair | ✓ | |
| Tourelle porte-objectifs rotative > Motorisée (6 positions) | ✓ | |
| Mise au point > Motorisée |
| |
| Mise au point > Dispositif de compensation de la dérive en Z | ✓ | |
| Têtes d’observation > Champ large (numéro de champ : 22) > Binoculaire inclinable | ✓ | |
| Illuminateur > Illuminateur de Köhler à lumière transmise > Lampe à DEL | ✓ | |
| Illuminateur > Illuminateur de Köhler à lumière transmise > Lampe halogène de 100 W | ✓ | |
| Illuminateur > Illuminateur pour fluorescence > Lampe à mercure de 100 W | ✓ | |
| Illuminateur > Illuminateur pour fluorescence > Éclairage avec guide de lumière | ✓ | |
| Tourelle de miroirs à fluorescence > Motorisée (8 positions) | ✓ | |
| Platine > Motorisée | Contact your local sales representative to hear about motorized stage options | |
| Condenseur > Motorisé > Condenseur universel | Distance de travail 27 mm, ouverture numérique 0,55, ouverture motorisée et polariseur | |
| Condenseur > Réglage manuel > Condenseur universel | O. N. : 0,55 / Distance de travail : 27 mm | |
| Condenseur > Réglage manuel > Condenseur à ultra-grande distance de travail | O. N. : 0,3 / Distance de travail : 73,3 mm | |
| Scanner confocal | - | |
| Traitement pour très grande résolution | - | |
| Accessoires | Contrôleur de bague de correction à distance (IX3-RCC) | |
| Dimensions (L × P × H) | 323 (L) × 475 (P) × 706 (H) mm (statif de microscope IX83) | |
| Poids | Env. 47 kg (IX83P2ZF) |