Not Available in Your Country
Sorry, this page is not
available in your country.
Vue d’ensemble
 |
Imagerie automatisée
|
|---|
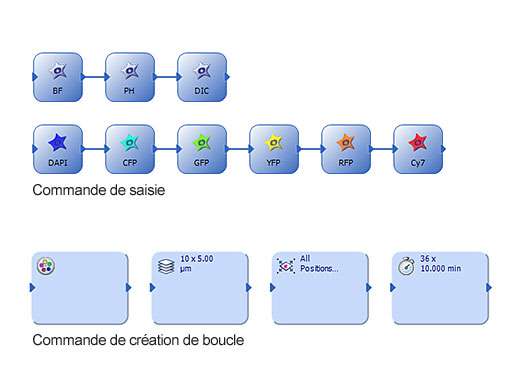 | Facilité d’utilisationLe gestionnaire d’expériences graphique (GEM) du logiciel cellSens Dimension permet une observation multidimensionnelle entièrement automatisée (X, Y, Z, T, longueur d’onde et positions) et facilite la configuration de l’expérience. To increase efficiency, you can define macro functions, such as executing deconvolution processing, in the GEM. |
|---|
Matériel précis et fiableMise au point automatiséeLa carte de mise au point multipoint du logiciel cellSens permet une mise au point automatisée dans de grandes zones d’images avec plusieurs objectifs, ce qui vous permet de conserver plus facilement la mise au point lorsque vous parcourez les échantillons. Illumination en fluorescence claire et uniformeL’illuminateur pour fluorescence (IX3-RFALFE) incorpore un système de lentilles de type œil de mouche qui assure une répartition uniforme de la lumière. Le système offre un éclairage lumineux et uniforme dans l’ensemble du champ d’observation, ce qui est pratique pour les applications d’assemblage d’images. | 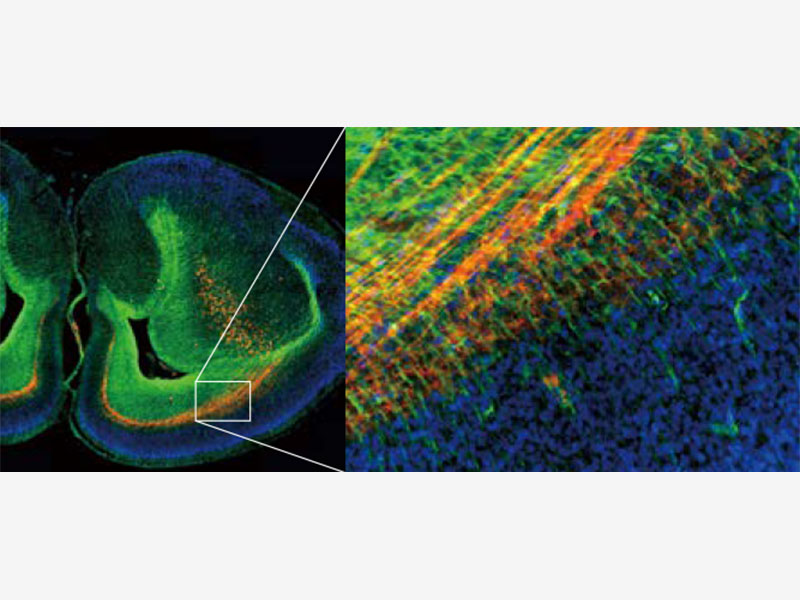  |
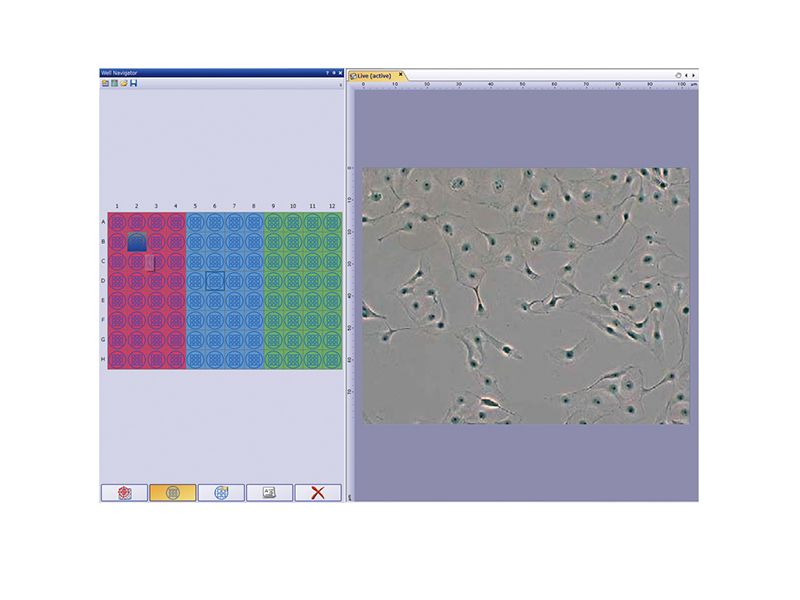 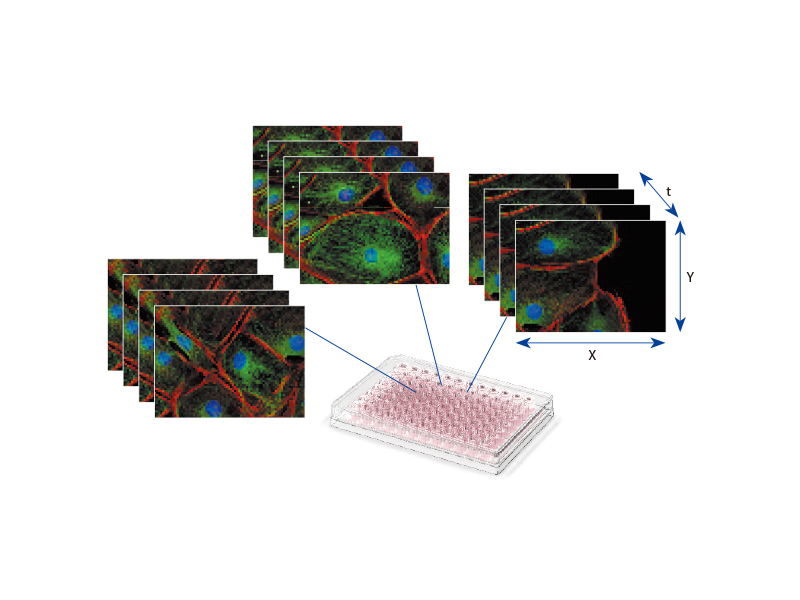 | Plaques à puits faciles à utiliserLe navigateur pour plaques à puits et les solutions de base de données pour le logiciel cellSens facilitent l’analyse des puits pendant une expérience. Ensemble, ils améliorent l’efficacité de l’observation et de l’analyse des images de plaques à puits grâce à la production d’une grande quantité de données. Les informations telles que la date, le nom du fichier ou le numéro de plaque à puits sont facilement sélectionnables au moyen d’icônes, et permettent d’afficher toute sélection d’images saisies à utiliser pour des analyses ultérieures. Ces solutions permettent également une analyse continue des images sélectionnées (fonction macro de lot) à l’aide de l’interface graphique pour plaques à puits. |
|---|
Déconvolution rapideLe logiciel cellSens Dimension d’Olympus offre la correction en direct des images 2D brouillées pour la prévisualisation et l’acquisition d’images, ce qui améliore la mise au point des échantillons épais. Si vous souhaitez obtenir encore plus de détails, la fonction de déconvolution TruSight est disponible pour réattribuer la lumière hors foyer. TruSight utilise un algorithme de déconvolution itérative restreinte pour améliorer la résolution, le contraste et la plage dynamique à une vitesse inégalée par traitement par processeur graphique. To improve experiment efficiency, deconvolution processing can be defined as a macro function in the GEM. |  Gauche : Sans TruSight / Droite : Avec TruSight |
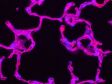
.jpg?rev=F33E) .jpg?rev=2A2D)  | Simplifiez votre flux de travauxObjectifs adaptés à l’observation avec des récipients en plastiqueLes objectifs de la série LUCPLFLN, et notamment l’objectif UCPLFLN20XPH (O. N. : 0,7), sont particulièrement adaptés à l’observation dans des boîtes en plastique. Ces objectifs permettent une observation haute résolution du processus de prolifération cellulaire et améliorent le contraste sur une zone étendue. Cela vous offre la possibilité d’acquérir des images avec des boîtes à fond plastique en plus des dispositifs en verre. * Image : cellule souche pluripotente induite exprimant le gène rapporteur Nanog (GFP). Données d’images fournies avec l’aimable autorisation de : Tomonobu Watanabe, Ph.D. Laboratory for Comprehensive Bioimaging, RIKEN Quantitative Biology Center |
|---|
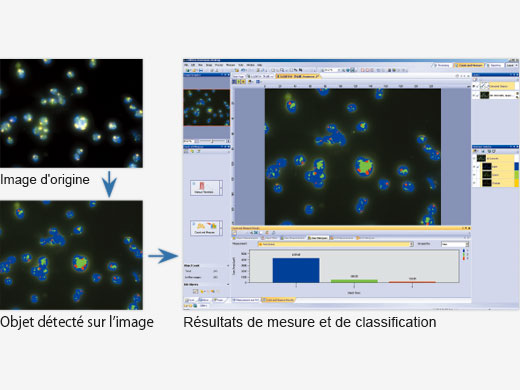
Analyse avancéeLes images peuvent facilement être converties en données utiles sur le plan statistique à l’aide du logiciel cellSens. Ce dernier comprend des fonctions de définition de zone d’intérêt, d’analyse de phase et de numération des cellules. Exportez en un seul clic les données de mesure brutes vers le logiciel Microsoft® Excel® ou un classeur cellSens. |
|
RéférencesL. Kruger, et al. Ductular and proliferative response of esophageal submucosal glands in a porcine model of esophageal injury and repair. Gastrointestinal and Liver Physiology (1er juin 2017). A. Urakami, et al. Development of a novel virus-like particle vaccine platform that mimics immature form of alphavirus. Clinical and Vaccine Immunology (17 mai 2017). A. S. Hasan, et al. Cardiosphere-derived cells facilitate heart repair by modulating M1/M2 macrophage polarization and neutrophil recruitment. PLoS ONE (20 octobre 2016). S. McKenna, et al. Perinatal endotoxemia induces sustained hepatic COX-2 expression through an NFκB-dependent mechanism. Journal of Innate Immunity (29 avril 2016). D. H. Adams, et al. Data on keratin expression in human cells cultured with Australian native plant extracts. Data Brief (16 mars 2016). H. Doi, et al. Potency of umbilical cord blood- and Wharton’s jelly-derived mesenchymal stem cells for scarless wound healing. Scientific Reports (5 janvier 2016). D. Seko, et al. μ-Crystallin controls muscle function through thyroid hormone action. The FASEB Journal (30 décembre 2015). Y. Ono, et al. Muscle stem cell fate is controlled by the cell polarity protein Scrib. Cell Reports (24 février 2015). |
Besoin d’aide? |
Caractéristiques techniques
| Monture de microscope | IX83P2ZF | |
|---|---|---|
| Méthode d’observation > Très grande résolution | - | |
| Méthode d’observation > Confocal | - | |
| Méthode d’observation > Fluorescence par réflexion interne totale | - | |
| Méthode d’observation > Fluorescence (excitation bleue/verte) | ✓ | |
| Méthode d’observation > Fluorescence (excitation ultraviolette) | ✓ | |
| Méthode d’observation > Contraste interférentiel différentiel (CID) | ✓ | |
| Méthode d’observation > Contraste de phase | ✓ | |
| Méthode d’observation > Fond clair | ✓ | |
| Tourelle porte-objectifs rotative > Motorisée (6 positions) | ✓ | |
| Mise au point > Motorisée |
| |
| Mise au point > Dispositif de compensation de la dérive en Z | ✓ | |
| Têtes d’observation > Champ large (numéro de champ : 22) > Binoculaire inclinable | ✓ | |
| Illuminateur > Illuminateur de Köhler à lumière transmise > Lampe à DEL | ✓ | |
| Illuminateur > Illuminateur de Köhler à lumière transmise > Lampe halogène de 100 W | ✓ | |
| Illuminateur > Illuminateur pour fluorescence > Lampe à mercure de 100 W | ✓ | |
| Illuminateur > Illuminateur pour fluorescence > Éclairage avec guide de lumière | ✓ | |
| Tourelle de miroirs à fluorescence > Motorisée (8 positions) | ✓ | |
| Platine > Motorisée | Contact your local sales representative to hear about motorized stage options | |
| Platine > Mécanique > Platine mécanique IX3-SVR avec molette à droite |
| |
| Platine > Mécanique > Platine mécanique IX3-SVL avec molette courte à gauche |
| |
| Condenseur > Motorisé > Condenseur universel | Distance de travail 27 mm, ouverture numérique 0,55, ouverture motorisée et polariseur | |
| Condenseur > Réglage manuel > Condenseur universel | O. N. : 0,55 / Distance de travail : 27 mm | |
| Condenseur > Réglage manuel > Condenseur à ultra-grande distance de travail | O. N. : 0,3 / Distance de travail : 73,3 mm | |
| Scanner confocal | - | |
| Traitement pour très grande résolution | - | |
| Accessoires | - | |
| Dimensions (L × P × H) | 323 (L) × 475 (P) × 706 (H) mm (statif de microscope IX83) | |
| Poids | Env. 47 kg (IX83P2ZF) |