スフェロイドにおける細胞分裂の三次元解析
細胞核と微小管を染色することによって、スフェロイド内の細胞分裂を視覚化することができます。共焦点レーザー顕微鏡で取得した画像とNoviSightソフトウェアのカウントモジュールを使用して、スフェロイド内の有糸分裂細胞の数を定量的に評価することができます。
目的
がん組織の悪性度は、有糸分裂細胞または異型分裂細胞の数を計測することによって評価されます。通常、有糸分裂がん細胞の数はフローサイトメトリーによって決定されます。その手法では、培養細胞が2次元か3次元かにかかわらず、がん組織を分離して核を染色することによって、有糸分裂細胞の数をカウントします。しかし、フローサイトメトリーは組織の本来の3次元構造を視覚化することができないため、がん組織内の有糸分裂細胞の位置を特定することができません。また、腫瘍の大きさなどの形態学的情報と細胞分裂との関係を解析することは困難です。本研究では、核と微小管を染色してから組織を透明化することによって、空間情報を保ったまま、がんスフェロイド内部の有糸分裂細胞を視覚化することに成功しました。この手法をNoviSightソフトウェアと組み合わせることにより、有糸分裂細胞の数をカウントすることができました。画像の定量解析を行うことで、有糸分裂細胞と異型分裂細胞の位置を特定することができました。
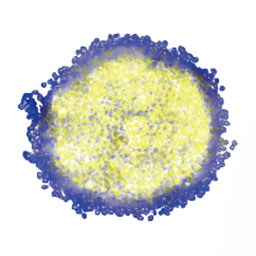
サンプルの作製
HT-29の細胞懸濁液を、1ウェル当たりの細胞数が500個になるようにPrimeSurface®96Uプレート(住友ベークライト株式会社)に播種しました。5日間の培養後に、細胞がスフェロイド構造を形成したため、我々はさまざまな濃度のパクリタキセルでスフェロイドを処理しました。パクリタキセルの添加後にスフェロイドを48時間培養し、4%パラホルムアルデヒドで固定しました。Hoechst
33342(同仁化学研究所)とAlexa Fluor
488に抱合した抗チューブリン抗体(eBioscience)で、細胞核と微小管をそれぞれ染色しました。染色したスフェロイドを37°Cで一晩、組織透明化試薬のScaleS4で処理しました。
結論
蛍光画像の取得と解析
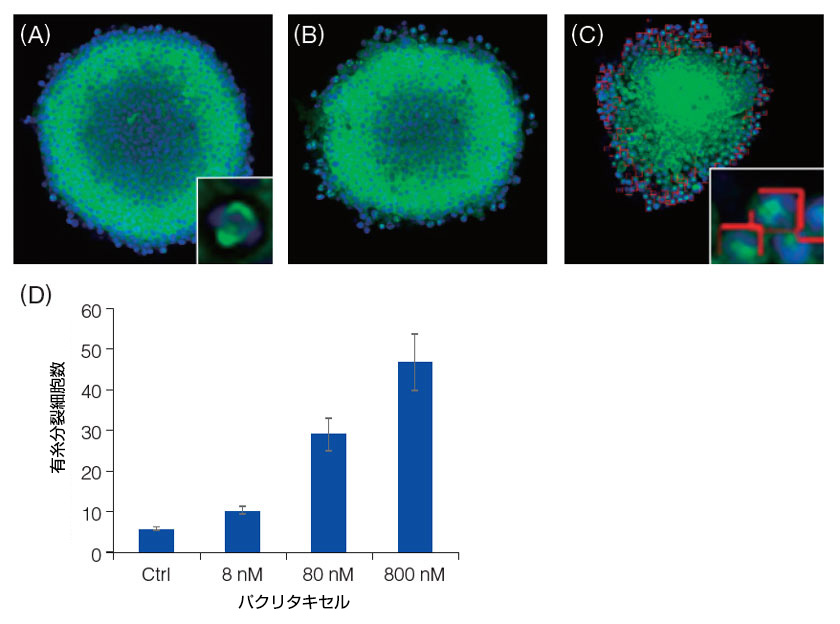
共焦点走査型レーザー顕微鏡FV3000を使用して、スフェロイドの蛍光画像を取得しました。処理を施していない対照群では、スフェロイドの表面から3つの細胞層において、有糸分裂細胞に固有の特徴である微小管による紡錘体の形成が認められました(A)。NoviSightソフトウェアを使用して、対照群とパクリタキセル処理群における有糸分裂細胞の数をカウントしました(B、C)。その結果から、パクリタキセルが有糸分裂細胞の数を濃度依存的に増加させたことが分かります(D)。この結果は、微小管脱重合阻害剤としてのパクリタキセルの効果をはっきりと示しています。
PrimeSurfaceは、住友ベークライト株式会社の登録商標です。
Olympusはオリンパス株式会社の登録商標であり、NoviSightおよびInsightful Analysis、Intelligent Answersはオリンパス株式会社の商標です。
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。
関連する製品はありません
このページはお住まいの地域ではご覧いただくことはできません。
Redirecting
You are being redirected to our local site.
このページはお住まいの地域ではご覧いただくことはできません。