高信頼性・高速撮像・低光毒性・深部観察を同時に実現する超解像イメージングシステムの原理
はじめに
蛍光タンパク質研究の発展とともに、細胞や組織の特定の構造や機能を生きたまま観察できるライブ蛍光イメージングの応用が進んだことで、蛍光顕微鏡は生命科学研究に不可欠な存在となりました。その中でも、近年では、従来の光学顕微鏡では観察できなかった200nm(nm=10-9m)以下の微細な構造を観察できる様々な超解像顕微鏡法が開発され、生命科学研究の発展に寄与する新たなツールとして注目されています。しかし、超解像顕微鏡法はまだ発展途上であるため課題も多く、特にライブ蛍光イメージングへの適用は時間分解能や光毒性などの面で課題もあるのが現状です。また、多くの超解像顕微鏡法は演算処理を伴うため、画像データの信頼性(定量性)も注意すべき重要なポイントです。推定処理や空間周波数をシフトさせる画像処理では、本来標本には存在しない構造(アーティファクト)を作り出す可能性があり、誤った研究結果を招くおそれがあります1。
そこで、オリンパスは、共焦点蛍光顕微鏡の超解像性と光学セクショニングに着目し、スピニングディスク型共焦点超解像システムIXplore SpinSRを開発しました。IXplore SpinSRは、従来の超解像技術では達成できなかった「高信頼性」・「高速画像取得」・「低光毒性」・「深部観察」を同時に実現します。独自の超解像技術であるOlympus super resolution(OSR)は、光学理論に基づいた超解像処理により、信頼性の高い結果を提供しながら、空間分解能120nmを実現します。また、スピニングディスク型の共焦点蛍光顕微鏡法をベースとすることで画像取得速度を向上させ、超解像ディスクSoRaを用いて光照射量を従来比約1/3に抑えることにより、低光毒性も実現しました2。深部観察は、シリコーンオイル浸対物レンズ3、及び共焦点顕微鏡の光学セクショニングによって、表面から離れた標本深部においても分解能の高い超解像画像が取得可能です。
本稿では、信頼性の高い超解像技術OSRの原理と、OSRを実現するIXplore SpinSRの光学設計に焦点を当てて説明します。
超解像の定義
蛍光顕微鏡の空間分解能は、二つの微小な点を見分けられる最小の距離とされ、2点分解能として定義されます。有名なレイリーの定義では、蛍光顕微鏡の空間分解能δrは式(1)で表されます。
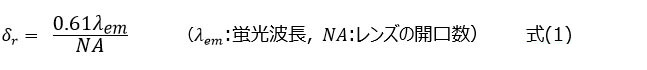
式(1)で示した分解能δrは、ある1点から生じた蛍光が像面に形成する強度分布をもとに決まります。この強度分布を点像分布関数(PSF: Point spread function)といいます。図1に示すように、2点間の距離がレイリーの分解能δr以下になると、強度分布の重なりが大きくなり、2つの点を見分けることが困難となります(レイリーの分解能のとき、2点間の強度低下は最大で26%)。
PSFの拡がりは結像のカットオフ周波数に依存しており、分解能とカットオフ周波数は裏表の関係にあります。カットオフ周波数が高くなると、解像力が上がり分解能の値は小さくなります。ワイドフィールド蛍光顕微鏡のカットオフ周波数ƒc_wf は、式(2)で表されます。
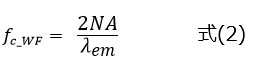
物体の発光強度分布に含まれる空間周波数の情報はカットオフ周波数ƒc_wf 以下に制限されて像面に伝達されます。そのため、カットオフ周波数ƒc_wf の逆数が、観察可能な構造周期の理論限界となります。式(2)のカットオフ周波数ƒc_wf で決まる解像力を超えた顕微鏡技術を、超解像顕微鏡法と呼んでいます。
共焦点蛍光顕微鏡の場合、理論的なカットオフ周波数はワイドフィールド蛍光顕微鏡のカットオフ周波数ƒc_wf の2倍になります。そのため、理論限界としては2倍の超解像性を有します。しかし、高周波数成分が微弱なため、一般的に、共焦点蛍光顕微鏡の解像力はワイドフィールド蛍光顕微鏡と同程度しか得られません。共焦点ピンホールを通常より絞り込むことで解像力を向上させることはできますが、たとえ無限小までピンホールを絞った場合においても、解像力の向上は1.4倍程度にとどまります。加えて、検出光量も低下するので、そのままでは超解像顕微鏡として実用的ではありません。
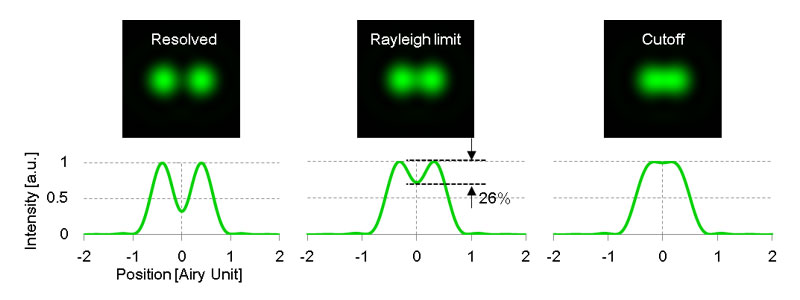
図1.2点分解能を示した模式図。
スピニングディスク型共焦点蛍光顕微鏡の採用による性能向上
IXplore SpinSRは、共焦点蛍光顕微鏡のカットオフ周波数付近の情報を最大限に引き出すことで、ワイドフィールド蛍光顕微鏡の2倍の解像力を達成しています。また、スピニングディスク型の共焦点蛍光顕微鏡を採用することにより、200fpsの高速な画像取得を実現しています。
共焦点蛍光顕微鏡では、観察試料に励起光スポットを照射して発生した蛍光を、共焦点ピンホールを通して検出します。その後、励起光スポットを二次元スキャナーで走査し、検出した蛍光信号の空間分布を画像化します。共焦点蛍光顕微鏡は、光の進行方向に対しても分解能を持つ(光学セクショニングを有する)ため、蛍光信号の三次元空間分布を取得するツールとして広く使われています。
スピニングディスク型の共焦点蛍光顕微鏡は、多数の励起光スポットを同時に照射するとともに、それぞれの励起光スポットから発生した蛍光を並列に検出する共焦点蛍光顕微鏡です。多数のピンホールを有する共焦点ディスクを中間結像面で回転させることにより、励起光スポットとピンホールを一体的に走査し、蛍光信号の空間分布をカメラに結像します(図2)。また、図2の右図に示したピンホール配置の拡大図のように、共焦点ディスク上のそれぞれのピンホールは十分に離れているため、相互に干渉せずに独立に作用します。
IXplore SpinSRでは、sCMOSカメラを利用することにより、検出感度を向上させています。sCMOSカメラは、共焦点顕微鏡で広く使われている光電子増倍管と比べて高い量子効率を持ちます。そのため、同じ強度の蛍光信号を検出した場合、光電子増倍管より高いSN比を得ることができます。IXplore SpinSRでは、さらに超解像ディスクSoRaを用いて、共焦点ピンホールによる蛍光信号の検出ロスを大幅に低減することで、低光毒性を実現しています(付属資料を参照ください)。
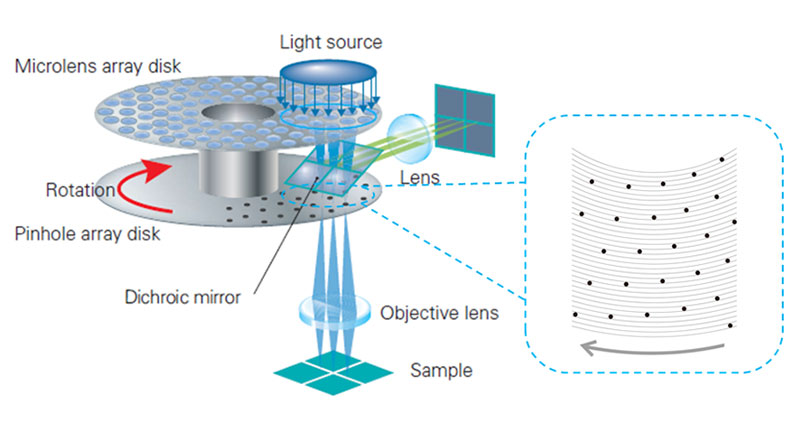
図2.スピニングディスク型の共焦点蛍光顕微鏡の光学系の模式図。共焦点ディスクは顕微鏡の中間結像面に配置されます。青い円部分に励起光が照射され、ディスクの中心を軸に回転します。右図は、標本に照射されるピンホール配置を拡大した模式図を示しています。それぞれのピンホールは十分に離れているため、相互に干渉せずに多数の励起光スポットを同時に走査できます。
OSRの原理
IXplore SpinSRは、ピンホール径を適切に設定することにより、ワイドフィールド蛍光顕微鏡と比べて2倍のカットオフ周波数まで信号の取得効率を向上させています4。取得した画像に後述のOSR処理を行うことで超解像画像を生成しますが、OSR処理はフィルタリング処理の一種で、画像内に含まれる空間周波数成分に対して、増幅・減衰のみを行っています。空間周波数をシフトさせないこと、及び、増幅・減衰率を光学理論に基づいて適切に設定することで、アーティファクトが少なく信頼性の高い画像を得ることができます。
フィルタリング処理としては他に、ウィーナーフィルターなどが一般的に知られており、デコンボリューションのひとつとして画像処理に用いられています。しかし、ウィーナーフィルターにはアーティファクトが生じやすいという欠点がありました。
OSR処理では、共焦点蛍光顕微鏡の高周波数成分を増幅させつつ、カットオフ周波数付近で緩やかに減少させるアポダイゼーションをかけた空間周波数フィルター(OSRフィルター)を用いています。これにより、アーティファクトを抑制しつつ、分解能を向上させます。図3aは、OSRフィルターとウィーナーフィルターの空間周波数ごとの増幅率を示しています。OSRフィルターは、中間周波数成分を必要以上に増幅せず、カットオフ周波数付近の高周波数成分を効率的に増幅していることが分かります。
ピンホール直径をレイリーの分解能相当に設定した共焦点蛍光顕微鏡に対し、OSRフィルターを適用したPSFと周波数特性(OTF: Optical transfer function)を図3bと図3cに示しています。これらの結果から、IXplore SpinSRはワイドフィールド蛍光顕微鏡の2倍の解像力を実現していることが分かります。
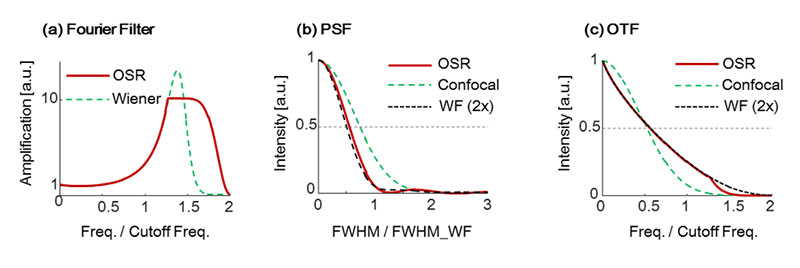
WF(2X)は、WF(カットオフ周波数を2xにしたもの)
図3.OSRフィルターの特性とその効果。(a)フィルター形状 (b) PSF (c) OTF。
図4は、OSRフィルターとウィーナーフィルターをそれぞれ適用したシミュレーション画像を示しています。図4cのOSRフィルター適用後の画像と図4dのウィーナーフィルター適用後の画像を比較すると、OSRフィルター適用後の方が、物体周辺のアーティファクトが少ないことが分かります。

図4.結像シミュレーションの結果。 (a)物体、(b)共焦点蛍光顕微鏡像、(c) OSRフィルターを適用した画像、(d)ウィーナーフィルターを適用した画像。
図5は、IXplore SpinSRで取得した生体標本の蛍光画像を示しています。標本として、アクチンフィラメントを染色した固定細胞を使用しました。励起波長は488 nm、対物レンズはUPLSAPO100XSを用いました。図5aはIXplore SpinSRのOSR処理前の画像、図5bはOSRフィルターを、図5cはウィーナーフィルターをそれぞれ適用した画像です。OSRフィルター適用後の画像は、処理前に比べて分解能が上がっており、さらにウィーナーフィルター適用後に比べてアーティファクトが少なくSN比が高い画像が得られています。このように、OSRフィルターは生体試料を用いたライブイメージングと定量解析に有用であることが確認できました。

図5.アクチンフィラメントを染色した固定細胞の蛍光画像。(a)SpinSR10で取得した共焦点蛍光画像、(b) (a)の画像の白枠内の一部画像に対しOSRフィルターを適用した画像、(c) (a)の画像の白枠内の一部画像に対しウィーナーフィルターを適用した画像。
その他の作例として、図6と図7に、IXplore SpinSRで取得した蛍光ビーズ(Φ100nm)と核膜孔を染色した固定細胞の蛍光画像を示しています。ここに示したように、OSRフィルターは高い信頼性と高いSN比を達成でき、IXplore SpinSRはライブ蛍光イメージングに適した超解像顕微鏡ということができます5。
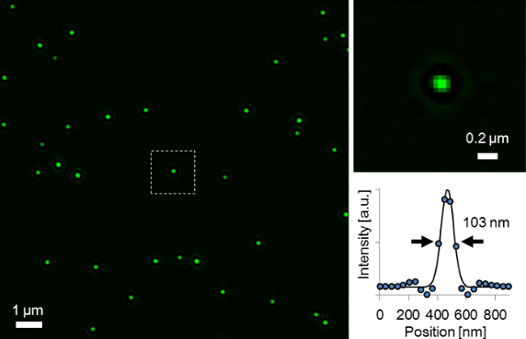
図6.IXplore SpinSRで取得した蛍光ビーズ(Φ100nm)の超解像画像と強度プロファイル。
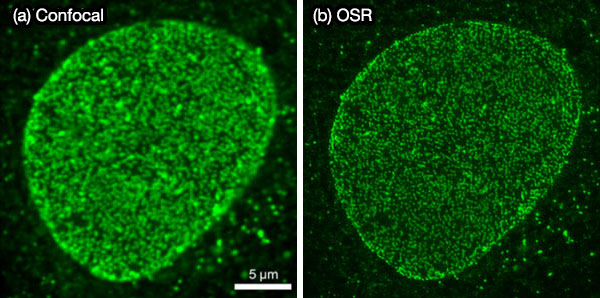
図7.核膜孔を染色した固定細胞の蛍光画像。(a) 共焦点画像、(b) OSR画像。
高品質な画像取得を実現する変倍光学系
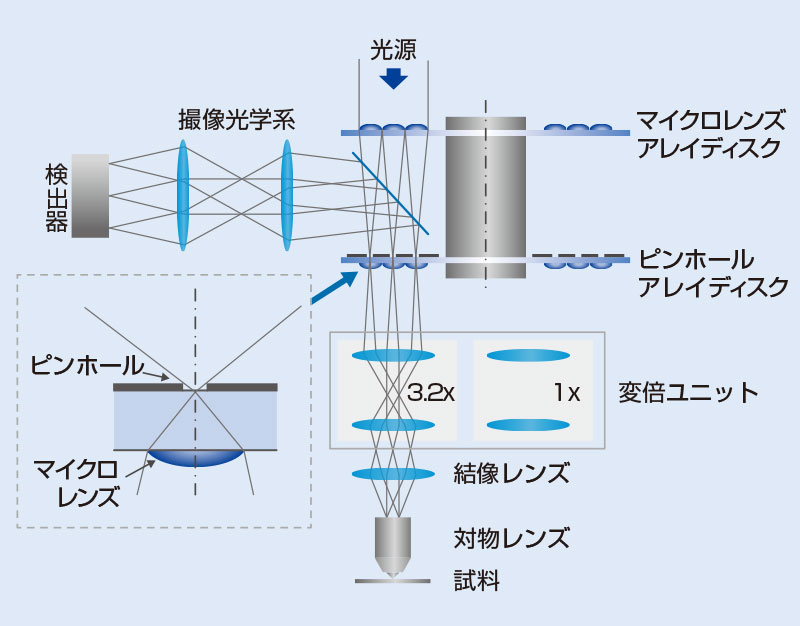
IXplore SpinSRは対物レンズ、結像レンズ、変倍光学系、共焦点スピニングディスク部、カメラで構成されます(図8)。励起レーザー光は共焦点スピニングディスク部へと導入されると、マイクロレンズアレイにより多数の光スポットに変換され、ダイクロイックミラーを透過し、マイクロレンズアレイの各焦点に配置されたピンホールを通過します。ピンホールを通過した光は、変倍光学系により、対物レンズの瞳径に適したビーム径に調整され、四分の一波長板(λ/4板)を通過します。その後、結像レンズを通り平行光となった励起光は、対物レンズにより、多数の励起光スポットとなって標本に照射され、蛍光を誘起します。標本から発生した蛍光は、励起光と同じ光路を逆方向に進み、変倍光学系によりピンホール径に適した集光径に調整され、ピンホールを通過します。ピンホールを通過した蛍光は、ダイクロイックミラーで反射され、カメラに結像します。
変倍光学系は、共焦点観察と超解像観察の切り替えに用いられています。超解像観察の光路では、図8aに示したように、蛍光スポットはピンホール径に合わせたサイズに拡大されます。また、図8bに示したように、励起光は対物レンズの瞳を満たすように拡大される一方、共焦点観察用の光路は、倍率を1倍とし、視野数18.8相当の広い視野での共焦点イメージングが可能です。
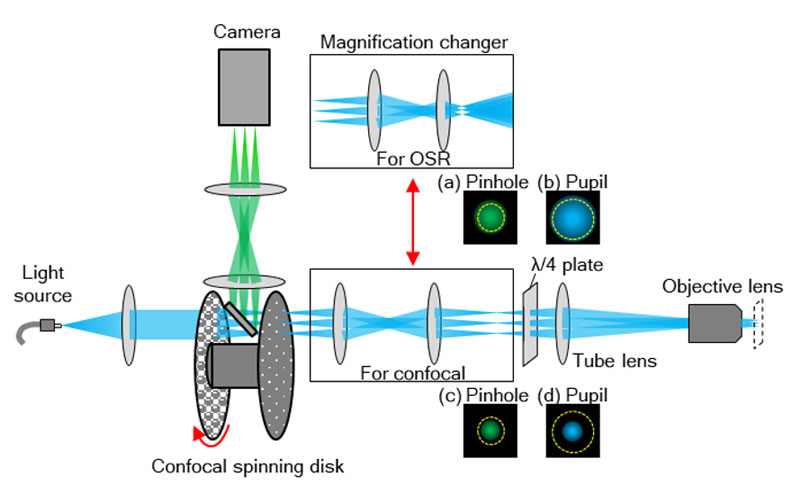
図8.装置の全体構成。共焦点観察と超解像観察は、変倍光学系によって切り替えます。(a)(c)蛍光スポットとピンホールのサイズを相対的に示した模式図。(b)(d)励起光のビーム径と対物レンズの瞳のサイズを相対的に示した模式図。(a)と(b)は超解像観察用の光路を通過した場合であり、(c)と(d)は共焦点観察用の光路を通過した場合です。
また、変倍光学系をIXplore SpinSRの専用設計とすることで、高いフラットネスを実現しています。変倍光学系には、顕微鏡本体の光学系と共焦点スピニングディスク部の収差を抑える役割があります。図9は、蛍光画像16枚(縦4枚x横4枚)を貼り合わせた画像を示しています。図9aと図9bの画像は、それぞれ一般的な変倍光学系で接続したシステムと専用の変倍光学系で接続したシステムで取得されたものです。一般的な変倍光学系で接続したシステムでは、それぞれの画像の接続部近辺の強度が落ち、本来標本には存在しない格子形状の強度分布が生じています。一方で、専用の変倍光学系で接続したシステムは高いフラットネスを実現しているため、画像同士の境界が見えない高品質な画像を取得できています。
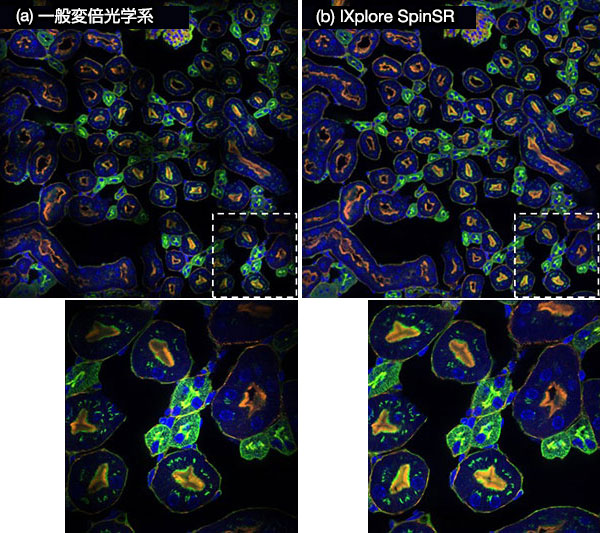
図9.IXplore SpinSR専用の変倍光学系で接続したシステム(b)と一般的な変倍光学系で接続したシステム(a)で取得した蛍光画像16枚(縦4枚x横4枚)を貼り合わせた画像。
λ/4板は、励起レーザー光の偏光状態を直線偏光から円偏光に変え、焦点面内(XY方向)で等方的な分解能を実現します。直線偏光のままで集光した回折限界のスポットでは、偏光方向(X)とそれに直行する方向(Y)の半値全幅が異なり、楕円形の励起光スポットとなります(図10のインセット参照)。図10の画像に示したように、対物レンズUPLSAPO100XSを用いて蛍光ビーズ(Φ100nm)を観察した場合、X方向とY方向の分解能に20%以上の乖離が生じます。変倍光学系の内部にλ/4板を配置し、直線偏光を円偏光に変えることで、微細構造を歪みなく観察することができます。なお、標本から発生した蛍光はランダム偏光であるため、検出側にはλ/4板の影響はありません。

図10.直線偏光時(a)と円偏光時(b)にそれぞれ取得した蛍光ビーズ(Φ100nm)の蛍光画像。インセットは、励起光スポットの計算結果。
まとめ
IXplore SpinSRは、従来のワイドフィールド蛍光顕微鏡及び共焦点蛍光顕微鏡で200nm程度に制限されていた空間分解能を、結像理論に基づいたオリンパス独自の超解像技術OSRと光学設計により、120nmに向上させました。OSRには、画像処理に空間周波数シフトや物体形状の推定を含まないため、最終的に得られる結果の信頼性が高いという特徴があります。IXplore SpinSRは、これまで解明できなかった新たな分子の動態を発見することができる有用な装置であることを確信しています。
付属資料:ライブセル超解像に適した明るいスピニングディスク
共焦点ピンホールにマイクロレンズを備えたスピニングディスクにより、従来よりも明るい超解像画像取得を実現します2。弱いレーザーパワーでのイメージングが可能になるため、サンプルに対する光毒性を抑えることができ、ライブセルイメージングに適しています。通常の共焦点顕微鏡の結像関係は、照明系のPSF(点像分布関数)と検出系のPSFとの積で表されます。ピンホールの光軸中心からDの位置の結像を確認すると、付図1のように照明系のPSFと検出系のPSFの積となり、光軸中心からD/2の位置情報を中心として伝達されていることが分かります。これは、D/2の位置の情報がピンホール上ではDに拡大されていることと同等になりますが、これを補正するために、マイクロレンズを用いてピンホールに投影される個々の焦点を1/2に光学的に縮小することにより、理想的な結像関係になります6-8。この場合の分解能は、ピンホールを無限小に小さくした場合の理想的な共焦点顕微鏡とほぼ等しくなり、高速で、細胞にやさしいスピニングディスクの特徴もそのまま維持されます。
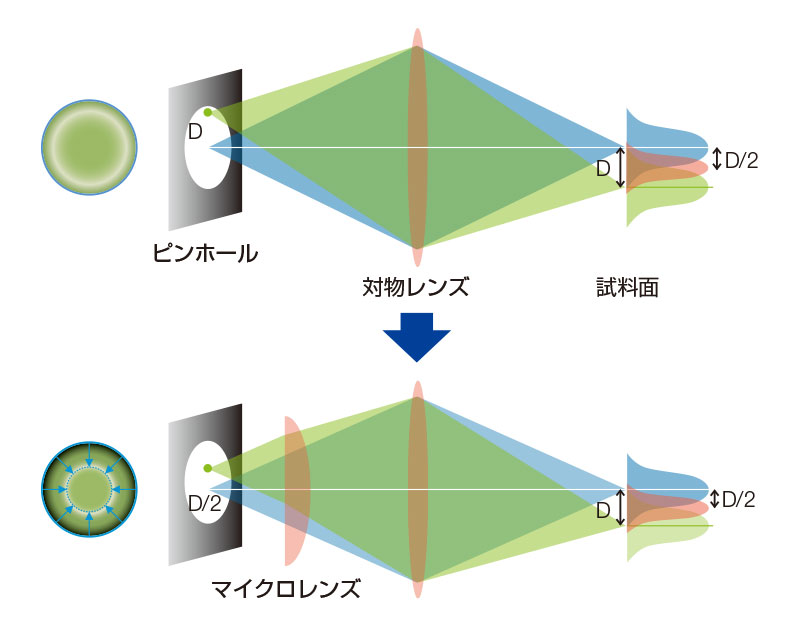
付図1.SoRaディスクを搭載したSpinSRの原理と構成
著者
オリンパス株式会社 R&D機能 光学システム開発
米丸 泰央
参考文献
- J. Lopez, et al. “A deconvolution revolution for confocal image enhancement”, BioOptics World, 55, Issue 01, pp. 85–88, January 2019.
- T. Azuma and T. Kei, "Super-resolution spinning-disk confocal microscopy using optical photon reassignment", Opt. Express, 23 (11), pp. 15003-15011, 2015.
- (White Paper) A. Samuelsson, “Silicone Immersion Objectives Answer the Call for Higher Resolution”
- S. Hayashi, "Resolution doubling using confocal microscopy via analogy with structured illumination microscopy", Jpn. J. Appl. Phys., 55 (8), 082501, 2016.
- S. Hayashi and Y. Okada, "Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics", Mol. Bio. Cell, 26 (9), pp. 1743–1751, 2015.
- C. J. R. Sheppard, “Super-resolution in confocal imaging”, Optik, 50, pp. 53-54, 1988.
- C. B. Müller and J. Enderlein, "Image Scanning Microscopy", Phys. Rev. Lett., 104, 198101, 2010.
- A. G. York, et al. "Instant super-resolution imaging in live cells and embryos via analog image processing", Nat. Methods, 10, pp. 1122-1126, 2013.
このページはお住まいの地域ではご覧いただくことはできません。