자체학습 현미경을 위한 scanR TruAI 사용으로 무표지 이행 분석
서론
세포가 관 내피 세포층을 통해 혈액에서 조직으로 이행하는 것을 경내피 이동이라고 합니다. 암세포 뿐 아니라 염증 조직의 백혈구도 전이 캐스캐이드의 중요 단계에서 이러한 과정을 거칩니다. 혈관외유출은 순환 백혈구, 후속적인 백혈구 롤링, 견고한 유착 및 이행의 캡처를 포함한 여러 연속적 과정으로 구성됩니다(그림 1).
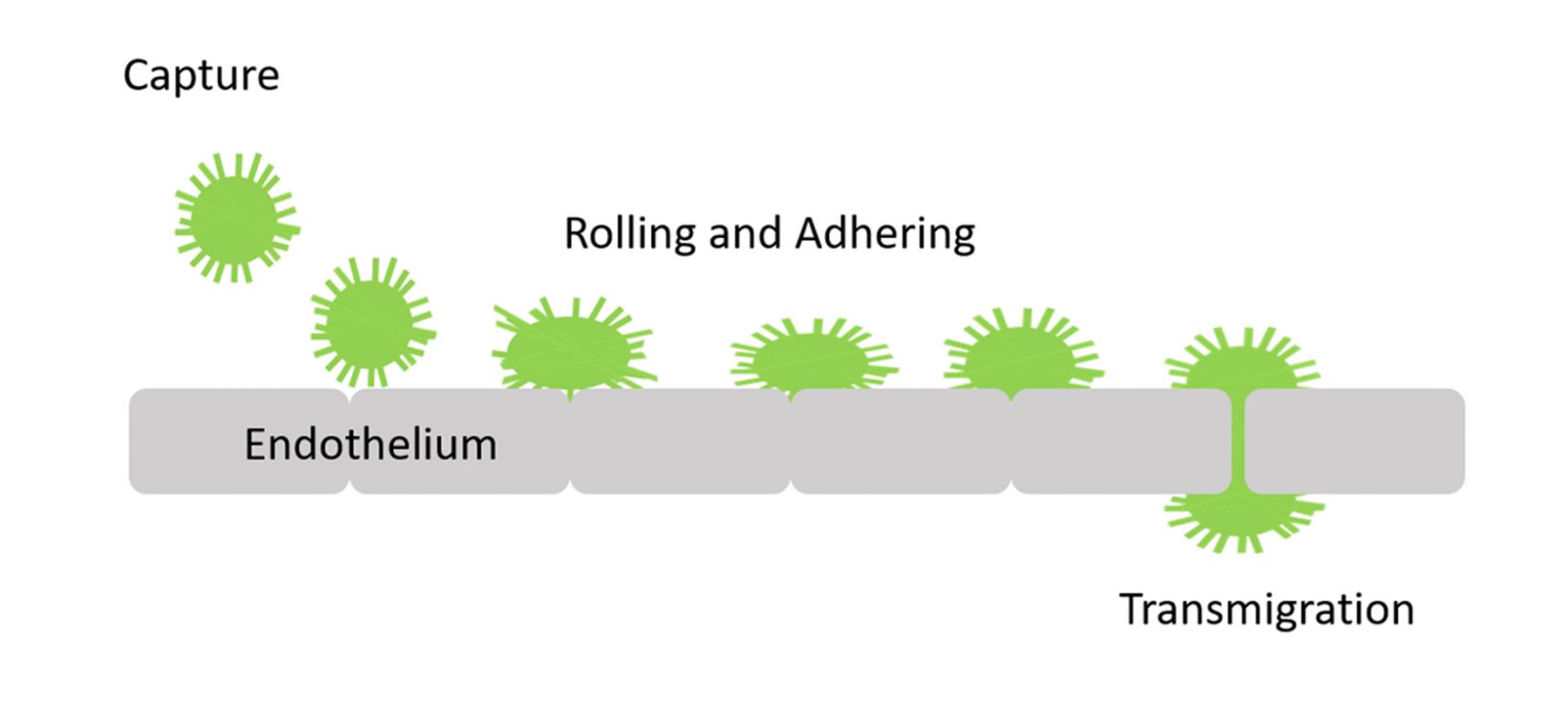 |  |
그림 1. 이행 과정의 표시. |
이러한 이벤트의 시각화는 일반적으로 형광과 위상차 현미경 검사를 결합하여 수행됩니다. 현미경은 플로 챔버를 사용하여 내피 세포의 단분자층에 걸쳐 형광으로 표지된 백혈구의 이행 동영상을 캡처합니다. 여기서 이행 이벤트는 백혈구의 콘트라스트 변경에 의해 나중에 인식될 수 있습니다(그림 2). 이 과정에 관련된 메커니즘을 조사하는 데 이행의 정량화가 중요합니다. 이는 일반적으로 녹화된 동영상에 대해서 주관적이며 노동집약적 절차에 해당하는 수작업으로 진행됩니다2.
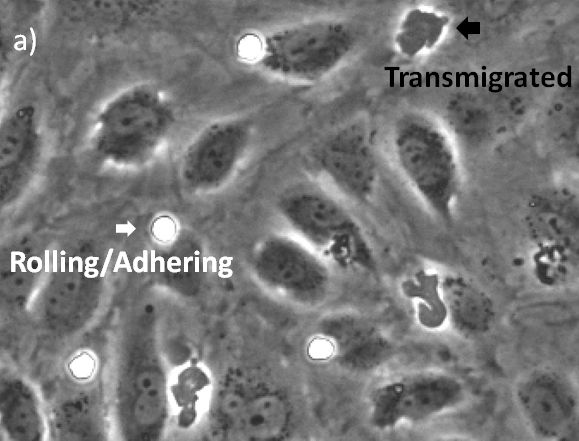 | 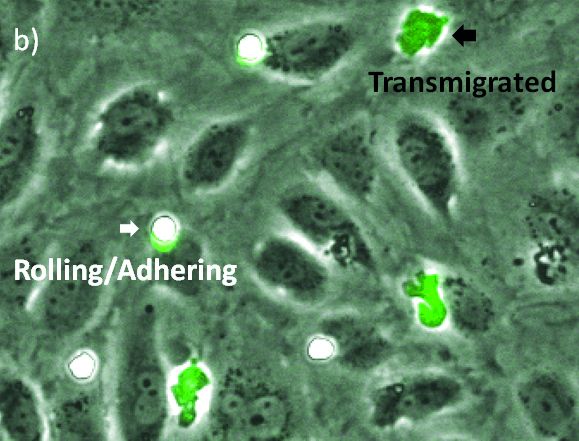 |
그림 2. a) 위상차, b) 위상차 및 형광. 롤링 및 부착 상태의 원형 백혈구가 고강도 및 둥근 모양으로 인해 위상차로 쉽게 시각화됩니다(흰색 화살표). 백혈구가 내피를 통해 이행되면 어둡게 되므로 식별이 더 어려워집니다(검은색 화살표). |
이행 이벤트의 자동 정량화는 이 방법이 더 객관적이고 시간 절약에 도움이 되므로 큰 이익이 됩니다. scanR 대용량 스크리닝 스테이션의 기본 모듈은 이미 형광 이미지 기반의 자동 정량화를 가능하게 합니다. 하지만 형광 표지가 백혈구의 기능에 영향을 미치고 이에 따라 이주 과정 자체가 영향을 받기 때문에 형광 신호의 필요 없이 이러한 과정을 정량화하는 것은 추가 개선이 될 것입니다3.
목적
이 애플리케이션 노트에서는 위상차만 필요하기 때문에 딥 러닝 적용이 분석을 현저히 단순화할 수 있다는 것을 보여줍니다. 또한 딥 러닝 결과가 형광 기반 분석을 능가하는 것이 확인되었습니다. 정량화가 다음과 같이 이행 캐스캐이드를 두 가지 상태로 구분하며 자동으로 수행될 수 있습니다. 1) 이행 전 롤링/부착 상태 및 2) 세포들이 내피 단분자층을 통해 이행된 후.
이를 달성하기 위해 딥 신경망은 scanR 소프트웨어의 TruAI 딥 러닝 기술을 사용하여 위상차의 이러한 두 가지 세포 상태를 확고히 식별하도록 쉽게 교육될 수 있습니다. 또한 scanR 운동 모듈을 적용하여 이 방법을 통해 이행 과정에 대한 동적 정보를 얻을 수 있습니다.
자체학습 현미경 검사
교육 실험에서 형광으로 표지된 백혈구가 TNFα-자극된 내피 세포의 단분자층이 포함된 현미경 챔버 슬라이드에서 유동합니다. 이행 과정이 위상차 및 형광으로 35분 동안 25초마다 타임 랩스 실험에서 슬라이드의 다중 위치에서 기록됩니다.
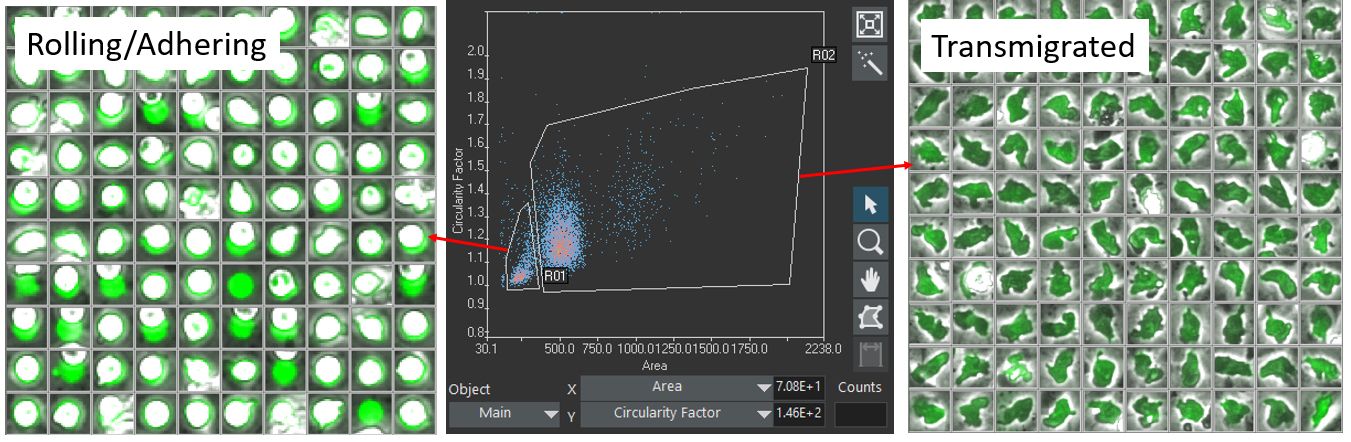
표지된 세포는 scanR 분석 소프트웨어를 통해 자체 형광에 따라 분할됩니다. 검출된 세포는 각기 크기, 모양 및 형광 강도에 따라 제어되어 두 가지 대상 클래스 간의 구별이 가능합니다. (클래스 1) 롤링/부착 상태 및 (클래스 2) 이행된 상태(그림 3).
다음으로 위상차 채널에서만 두 세포 상태를 식별하도록 딥 신경망을 교육하는 데 각 클래스를 사용합니다.
딥 신경망 적용
생성된 딥 신경망은 교육에 사용되지 않은 챔버 슬라이드의 두 위치에서 위상차 이미지에 적용됩니다.
수천 개의 세포에 대해 평가된 결과는 딥 러닝이 형광조차도 능가하는 것을 가리킵니다. 그 이유는 일부 세포가 이행됨에 따라 자동으로 검출될 수 없게 되면 형광 신호를 심하게 상실하기 때문입니다(그림 4).
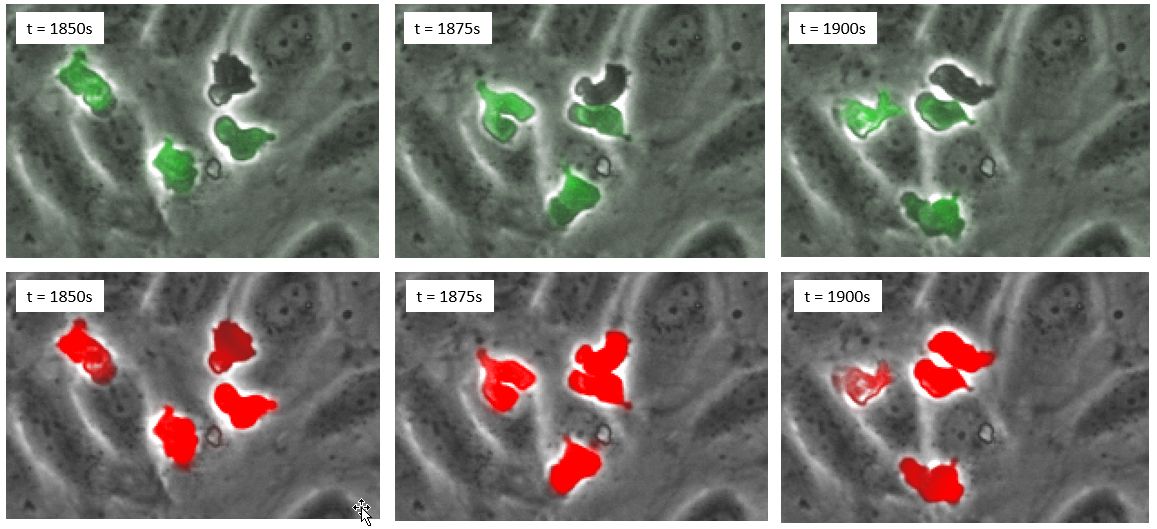
백혈구 검출에 대해 딥 신경망이 형광을 능가하는 것을 확인한 후 형광으로 표지할 필요가 없었습니다. 결과적으로 백혈구가 형광으로 표지되지 않은 새 실험으로 새로운 독립적인 데이터 세트를 생성하였습니다. 그런 다음 동일한 딥 신경망이 위상차 이미지에 적용되어 시간의 흐름에 따라 두 세포 상태가 식별되었습니다(그림 5).
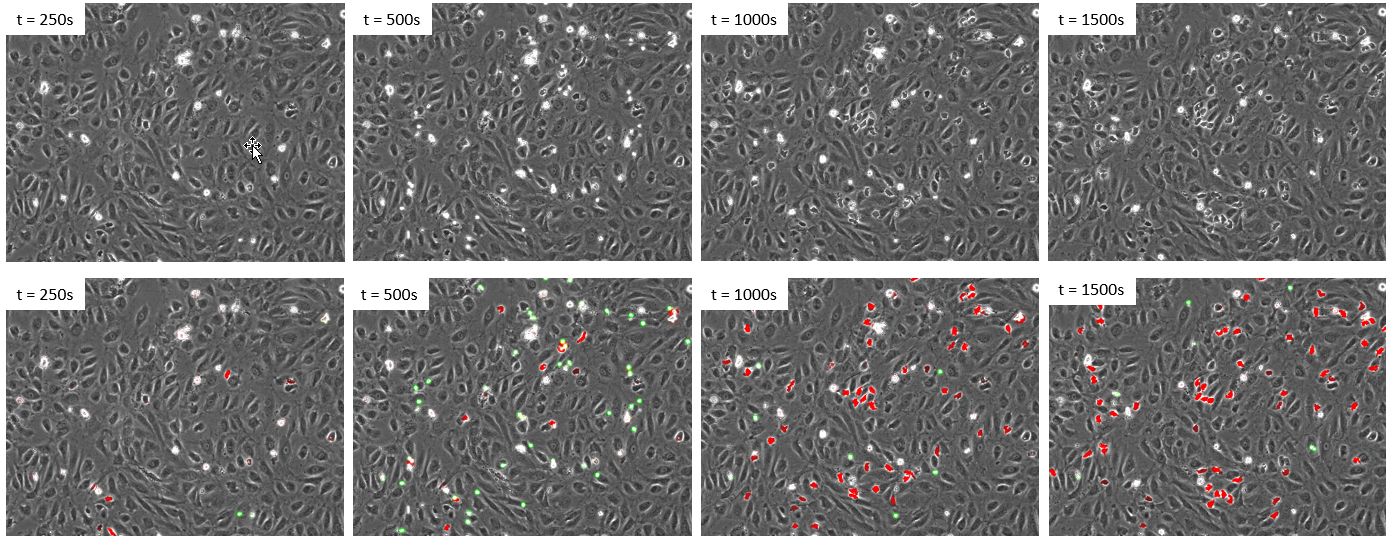
그림 5. 백혈구가 형광으로 표지되지 않은 새로운 데이터 세트의 타임 랩스. 상단 패널: 위상차. 하단 패널: 클래스 1 세포(녹색) 및 클래스 2 세포(빨간색)의 위상차 및 딥 러닝 예측.
외관 검사에서는 딥 신경망이 위상차만을 사용하여 세포의 두 상태에 대한 확실한 검출을 가능하게 하는 것을 확인합니다. 다음으로 시간의 흐름에 따라 각 상태의 세포의 총수를 표시하여 이행률을 평가합니다(그림 6).
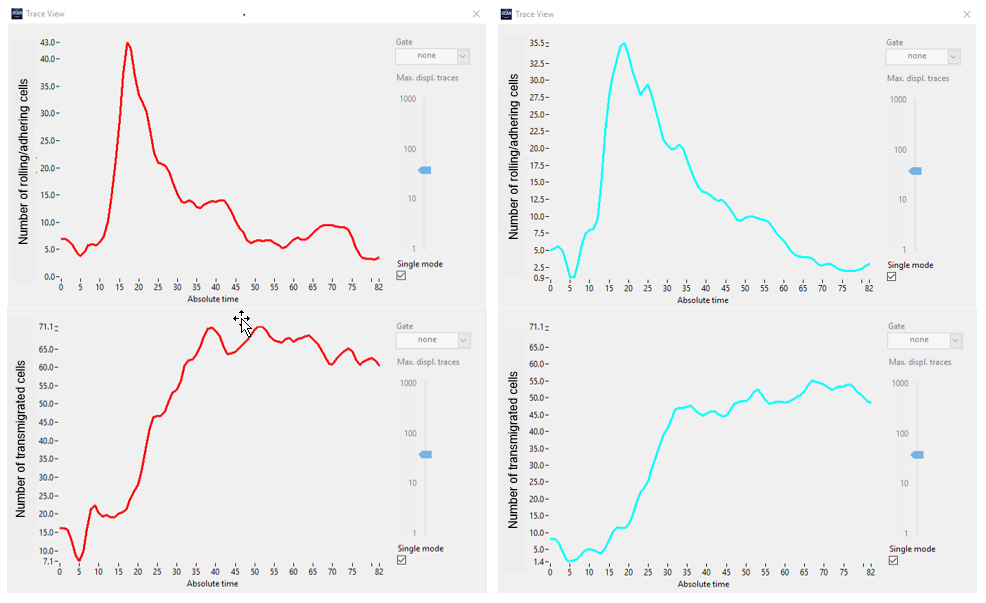
그림 6. 각기 다른 두 세트의 실험(빨간색 대 청록색)에서 클래스 1(롤링/부착, 상단)과 클래스 2(이행됨, 하단)의 세포 수.
또한 scanR 시스템의 운동 모듈을 사용하여 시간의 흐름에 따라 개별 세포를 추적하고 이행 과정을 따라갔습니다(그림 7).

그림 7. 시간의 흐름에 따라 개별 세포를 추적하고 해당 매개변수를 표시하여 이행 캐스캐이드의 동역학에 대한 정보를 얻었습니다. a) 시간의 흐름에 따라 세포가 롤링/부착 상태에 속할 확률. b) 시간의 흐름에 따라 세포가 이행된 상태에 속할 확률. c) 시간의 흐름에 따른 운동의 방향. d) 시간의 흐름에 따른 운동의 속도. e) 시간의 흐름에 따라 추적된 세포의 궤적. f) e)에 표시된 동일한 세포의 매 25초 시계열. a) b) c) 및 d)에 강조표시된 트랙은(빨간색) e)에 나타낸 세포와 일치합니다.
개별 세포의 운동 곡선은 이행 전에 세포가 운동 속도를 늦추고 3시점(75초) 지속되는 이행 이벤트에 대해 정적인 상태를 유지하는 것을 보여줍니다. 그런 다음 이행된 세포는 내피 단분자층 아래서 남은 실험 기간 동안 다시 자유롭게 움직입니다.
결론
이러한 이행 분석 기반의 새로운 딥 러닝 방법을 통해 무리할 필요 없이 이전에 자동화로 가능했던 것보다 훨씬 더 많은 정보를 얻을 수 있었습니다 또한 형광을 능가하는 빠르고 확실한 방법으로 부착 세포와 이행 세포를 구별할 수 있었습니다. 운동 분석을 통해 개별 세포에 대해 매우 상세히 이러한 과정의 동역학을 살펴볼 수 있었습니다. 상기 방법은 시간의 흐름에 따라 이행 이벤트의 속도와 이행된 세포의 비율에 대한 명확한 통찰력을 제공합니다.
참고문헌
1. Vestweber, D. How Leukocytes Cross the Vascular Endothelium. Nat Rev Immunol 15, 692–704 (2015). Doi:10.1038/nri3908.
2. Kroon J, Daniel, AE, Hoogenboezem M, Van Buul JD. Real-time Imaging of Endothelial Cell-cell Junctions During Neutrophil Transmigration Under Physiological Flow. J. Vis. Exp. (90), e51766, (2014). Doi:10.3791/51766. https://www.jove.com/video/51766/real-time-imaging-endothelial-cell-cell-junctions-during-neutrophil
3. Nolte MA, Kraal G, Mebius RE. Effects of Fluorescent and Nonfluorescent Tracing Methods on Lymphocyte Migration in Vivo. Cytometry A, 61 (1), 35-44, (2004). Doi: 10.1002/cyto.a.20074.
저자
M. Hoogenboezem and M. A. Nolte,
네덜란드 암스테르담 Sanquin 연구소 분자 및 세포 지혈과 연구 시설
E. G. G. Sprenkeler
네덜란드 암스테르담 Sanquin 연구소 혈구연구과
Manoel Veiga Gutierrez
독일 뮌스터 Johann-Krane-Weg 39 48149 Olympus Soft Imaging Solutions GmbH 응용 전문가.
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.