荧光成像自其出现开始就已成为生物研究的一个主要工具。它帮助了无数科学家从微观水平观察细胞结构和动态过程。
如果您曾使用荧光显微镜对生物样品进行成像,您甚至可能注意到组织中弥漫着微弱、无处不在的背景信号。该信号在不同结构中的强度不同,并且其强度可能会根据您激发源的波长而呈现变化。
然而,在您检查方案和笔记中出现的染色技术问题前,请考虑您样品的生物组成。它是否为细胞化构成?是否有色素?是否存在大量结构蛋白?如果您对这些问题中的任何一个回答“是”,那么您所看到的信号可能并不像自己想象的那样陌生。这些背景信号大多数都是天然发出的自发荧光。
生物学比您想象的更明亮―自发荧光定义
自发荧光是生物结构天然发出的光,是广泛存在于细胞和组织中的一种现象。这种现象由内源性分子组成成份呈现的荧光能力引起。与染色剂和染料中使用的经过设计的荧光染料一样,自发荧光分子通常包含多环碳氢化合物,具有可被入射光子激发的离域电子。自发荧光分子在受到入射光刺激后,会显示出对有效振动弛豫的耐受。因此,多余的能量会作为一个新光子被发射出去,与激发的光子相比,这种光子能量比降低,波长升高。虽然这些机制听起来很熟悉,但您可能会质疑,为何在日常生活中没有遇到过自发荧光。毕竟,您自己就是一个生物实体。然而,您并不会轻易发出荧光。
目前已知,有少数内源性分子(如甲壳素),在紫外线刺激下会发出荧光(见图1,左)。然而,与科学家们更习惯在实验室看到的经过设计的荧光染料相比,许多自发荧光体不太可能被入射光子激发。经过设计的造影剂的浓度同样可以在台式染色方案中进行调整,以限制或加强荧光信号,但天然自发荧光始终受生物浓度限制。
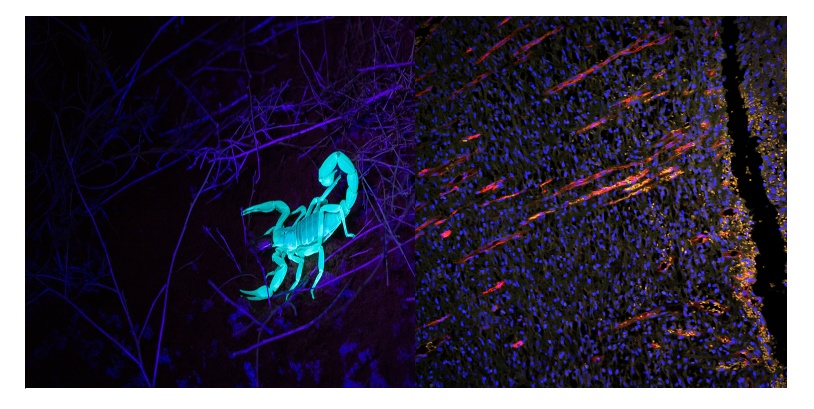
图1. 活体样品中的自发荧光示例。左图:紫外线(UV)刺激下蝎子的自发荧光。右图:外伤后10天的大鼠皮肤恢复图像,显示新血管在表皮层向伤口切口垂直生长。蓝色(DAPI):细胞核。橙色(自发荧光):皮肤组织。红色(CD31):血管。使用奥林巴斯BX51宽场荧光显微镜和DP71相机拍摄的图像。图像承蒙中国中医科学院实验研究中心LiShuang Li提供。
尽管大多数自发荧光在紫外-绿光范围内可以被激发,但自发荧光分子也有明显的激发窗口,并形成相对广泛的激发光谱。以上因素结合在一起,使得在使用带有专用荧光刺激光源和比肉眼更敏感的光子探测器的成像系统时,更容易遇到自发荧光现象(图1,右图:橙色信号)。
生命科学研究中常见的自发荧光来源
为了顺应研究成像实验中的自发荧光现象,您要考虑样品包含的生物组成成份。以下是研究人员在实验室中经常观察到的一些产生自发荧光的物质:
1.烟酰胺腺嘌呤二核苷酸
烟酰胺腺嘌呤二核苷酸,或称NAD(P)H,是一种分布于细胞质中的代谢辅助因子和电子载体,它是糖酵解和磷酸戊糖途径的一个关键组成成份。作为细胞代谢的一个关键组成成份,这意味着NAD(P)H的自发荧光现象几乎存在于所有活细胞中。为了执行其代谢功能,该分子以氧化(NAD+)和还原(NAD(P)H)状态天然存在。然而,只有NAD(P)H能够产生荧光。其对应的氧化物NAD+则不会产生自发荧光。激发:340纳米;发光:450纳米。(资料来源:Chance 等人,1979;Georgakoudi 等人,2002)。
2.黄素类物质
通常以黄素腺嘌呤二核苷酸(FAD)的形式存在,这种代谢辅酶在TCA循环和电子输送链中发挥重要作用。它主要位于线粒体中,其中活跃的代谢过程产生自发荧光信号热点。有些研究人员更愿意将黄素类物质的自发荧光称为“黄素蛋白荧光”,因为FAD在功能上与线粒体中的蛋白质复合物(如琥珀酸脱氢酶)结合。与NAD(P)H的情况相反,FAD只有氧化形式会产生荧光,而还原形式则不会。激发:380-490纳米;发光:520-560纳米。(资料来源:Chance 等人,1979;Deyl 等人,1980)。
3.胶原蛋白
胶原蛋白是一种关键的机械蛋白,可进行组装,创建各种支撑结构基质供大多数组织使用。它可见于皮肤的真皮层、内部器官的细胞外基质和周围血管系统。它也包含肌腱、韧带、头发和指甲。虽然在细胞培养物中很少看到胶原蛋白,但使用体内样品或整个组织进行成像实验的研究人员可能会发现胶原蛋白自发荧光现象不可避免。激发:270纳米;发光:390纳米。(来源:Georgakoudi 等人,2002)。
4.弹性蛋白
作为另一种突出的细胞外基质(ECM)蛋白,弹性蛋白经常与胶原蛋白夹杂在一起,使细胞外基质具有更多的机械延展性。弹性蛋白密集分布在血管系统周围,频繁经历弹性变形以应对血压变化。它也存在于皮肤中,并对来自深层骨骼和肌肉的运动发挥必要的互补作用。另外,研究人员对体内样品或整个组织进行成像时,必须了解诸如弹性蛋白的结构蛋白所引起的自发荧光现象。{激发:350-450纳米;发光:420-520纳米。(资料来源:Deyl 等人,1980)。
5.脂褐素
脂褐素是一种十分混杂的自发荧光分子,其结构小巧而鲜明清晰,可见于神经元、胶质细胞、骨骼肌细胞和心肌细胞等细胞的荧光光谱中。脂褐素在细胞培养物和整个组织中都可以被识别。人们注意到,随着样品经历生物老化,脂褐素逐渐变得更加明显。尽管脂褐素这个名称可能意味着该物质由脂质或脂蛋白造成,但人们认为其自发荧光信号是蛋白质、碳水化合物和脂质的混合体。激发:345-490纳米;发光:460-670纳米。(资料来源:Billinton and Knight 2001)。
6.色氨酸
色氨酸是一种必需的氨基酸,也是神经学研究中可能遇到的5-羟色胺和褪黑激素等信号分子的必要前体,是蛋白质生物合成的主要组成成份。它无处不在、不可低估,因为在大多数折叠蛋白中都可以找到色氨酸残留物,其自发荧光信号随后会渗透到细胞和组织中。由于其结构化学性质与蛋白质构象存在联系,研究人员已观察到色氨酸自发荧光的波长和强度变化与蛋白质结构及结合状态的变化存在函数关系。激发:280纳米;发光:350纳米。(来源:Ghisaidoobe和Chung 2014)。
7.黑色素
黑色素是一种天然色素,有助于皮肤、头发和眼睛的着色。黑色素由皮肤的表皮基底细胞产生,它充当了一种光保护分子,防止太阳的紫外线损坏表面皮肤细胞中的宝贵蛋白质和DNA。除非您直接培养黑色素细胞,否则在透过皮肤成像的实验中需要对黑色素进行最多的考虑,因为即使在同一样品中,黑色素的自然浓度和分布情况也会有所不同。激发:340-400纳米;发光:360-560纳米。(来源:Gallas和Eisner 1987)。
样品制备产生的荧光
上述光源从生物组织自然辐射光子。许多研究人员还遇到了非生物组成成份或实验室制备样品所需试剂发出的荧光。
例如,培养皿、孔板和细胞培养瓶的塑料底部都可能发出明亮的荧光,而且光谱很广。我们建议您在需要对生物样品进行荧光成像时,使用玻璃底或专门的无荧光聚合物容器。酚红是细胞培养基的一种常见添加剂,在对活细胞进行成像时也会极大地增加背景荧光。在开始任何成像实验之前,将您的培养基换成不含酚红的替代品,就可以轻松避免这种情况。
由于纸制品具有高度荧光性,因此纸质标签或贴纸也会引起类似的问题。当在容器或玻片上使用纸质标签时,请让标签远离您打算成像的样品。
最后,醛类固定剂通常用于即将死亡的样品或染色方案。戊二醛或甲醛等试剂与蛋白质发生反应,会在整个细胞和组织中产生荧光交联。用非醛类固定剂取而代之,能够防止计划外的荧光信号积累。
虽然这些示例并不是自发荧光的自然辐射源,但了解其来源和影响可以防止对图像数据产生不必要的影响。
如何对成像实验中不必要的自发荧光进行管理
目前为止,我们已确定了一些自发荧光体,并了解了在哪里可以发现它们。现在,问题来了。在开始成像实验之前,您如何对这些信号进行管理?
在简单的组织或单细胞培养物中,仔细选择商业染色剂的激发和发射光谱,并找到随附的缩窄滤光片,可避免主要的峰值自发荧光。这样做可以大大提升您的信噪比。
如果您的方案允许,选择量子效率较高的染色剂,或选用浓度更高的造影剂进行实验。这样做也可以加强信号,尽管成本更高。现代策略使用近红外(NIR)激发光和700纳米以上可激发的标签(如Cy7或Alexa Fluor 750),以避开常见自发荧光体的激发和发射范围(图2)。
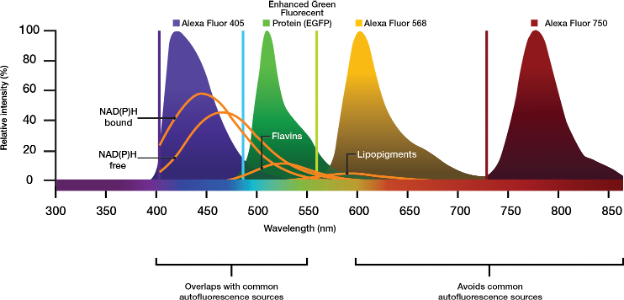
图2.相对于生物成像中常见的自发荧光分子,Alexa商业荧光染料的发射峰值。选择在近红外范围内激发和发射的造影剂可以避免自发荧光促成因素造成的不必要的发射。
如果实验允许存在灵活性,探究替代成像方式是否适用于您的实验。对于厚重的样品或组织,共焦或多光子显微镜系统可以将整体自发荧光促成因素降到最低。上述显微镜系统分别通过避免收集焦外光或将激发限制在焦平面内来实现对自发荧光因素的控制。
生物发光成像等技术完全去除了自发荧光体在您收集的数据中添加信号的可能性。发光实验不需要使化学发光反应发射光子的激发光,因此自发荧光体不会受到刺激。
当自发荧光信号因素无法在成像前得到调整时,采集后的图像处理技术(如光谱分层或背景减除)可作为有效的替代解决方案。这些计算技术要求研究人员梳理出样品中的内源性荧光染料,或者掌握有关自发荧光光谱的基本知识,以有效地去除其添加的信号。


