Desde sus inicios, el procesamiento de imágenes con fluorescencia se ha convertido en la herramienta básica de la investigación biológica. Ha permitido a un sinnúmero de científicos visualizar estructuras celulares y procesos dinámicos a un nivel microscópico.
Si en algún momento ha usado un microscopio de fluorescencia para procesar imágenes de tipo biológico, puede que haya notado una señal de fondo tenue, pero omnipresente, que penetra el tejido. Dicha señal puede variar en intensidad a través de diferentes estructuras, y tiende a presentar cambios en la intensidad en función de la longitud de onda de la fuente de excitación usada.
Sin embargo, antes de verificar los protocolos y las notas por técnicas de tinción erróneas, tenga en cuenta la composición biológica de su muestra. ¿Posee una estructura celular? ¿pigmentada? ¿Tiene una cantidad significativa de proteínas estructurales? Si ha respondido «sí» a cualquiera de estas preguntas, la señal que usted pueda estar viendo no es tan singular como parece. Algo, sino todo lo que presenta ese fondo, se emite de forma natural a modo de autofluorescencia.
La biología, más brillante de lo que se cree: Definir la autofluorescencia
La autofluorescencia, emisión natural de la luz a partir de estructuras biológicas, es un fenómeno ampliamente presente en las células y los tejidos. Es causada por componentes moleculares endógenos dotados de una respuesta fluorescente. De forma muy similar a los fluorocromos usados en las tinciones y los colorantes, las moléculas autofluorescentes normalmente se encuentran en los hidrocarburos policíclicos con electrones deslocalizados que pueden ser excitados por fotones entrantes. Las moléculas autofluorescentes muestran resistencia a la relajación vibratoria eficiente tras ser estimuladas por la luz recibida. Por tanto, la energía que excede se emite como un nuevo fotón dotado de un nivel de energía más bajo y una longitud de onda más alta que aquellos del fotón excitado. Si bien el mecanismo suena familiar, se estará preguntando por qué no experimenta la autofluorescencia en su vida cotidiana. Después de todo, el humano es un ente biológico. Pero, no es fácil emitir fluorescencia.
Unas cuantas moléculas endógenas, como la quitina, son bien conocidas por su autofluorescencia vibrante bajo una estimulación ultraviolenta (Figura 1, izquierda). Sin embargo, muchos de los autofluorocromos son menos propensos a ser excitados por los fotones entrantes a diferencia de sus equivalentes diseñados, cuya visualización es más habitual en los laboratorios por parte de los científicos. La concentración de los agentes de contraste diseñados también puede ajustarse en un protocolo de tinción de banco con el fin de minimizar o potenciar una señal de fluorescencia; no obstante, la autofluorescencia natural siempre está limitada a concentraciones biológicas.
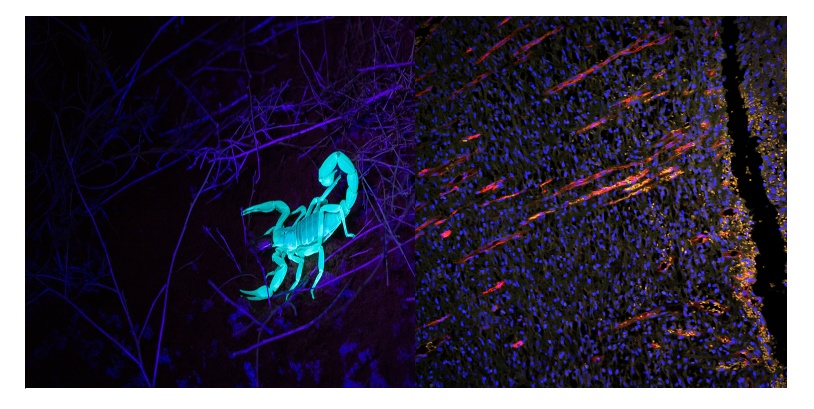
Figura 1. Ejemplos de la autofluorescencia en muestras vivas. Izquierda: Autofluorescencia en el escorpión bajo la simulación de luz ultravioleta (UV). Derecha: Imagen de la piel recuperada de una rata en el décimo día tras sufrir un trauma; se muestra neovascularización con crecimiento vertical hacia el corte de la herida en la capa epidérmica. Azul (DAPI): Núcleos. Naranja (autofluorescencia): Tejidos de la piel. Rojo (CD31): Vascularización. Imagen capturada con el microscopio de fluorescencia de campo amplio BX51 y la cámara DP71. Imagen por cortesía de LiShuang Li, Centro de Investigación Experimental, Academia China de Ciencias Médicas.
Las moléculas de autofluorescencia también se dotan de distintas ventanas de excitación a pensar que la mayoría de la autofluorescencia es excitable en el área verde UV y produce un espectro de excitación relativamente amplio. Estos factores, al combinarse, hacen que sea más común alcanzar la autofluorecencia si se usan sistemas de procesamiento de imágenes con fuentes de luz de estimulación de fluorescencia específicas y detectores de fotones más sensibles que el ojo humano (Figura 1; derecha: señal naranja).
Fuentes comunes de autofluorescencia en la investigación de las ciencias de la vida
Para responder a la presencia de la autofluorescencia en los experimentos de procesamiento de imágenes en la investigación, tenga en cuenta los componentes biológicos que comprometen sus muestras. A continuación, se listan algunos de los productores de autofluorescencia frecuentemente observados en laboratorio:
1. Dinucleótido fosfato de nicotinamida y adenina
El dinucleótido fosfato de nicotinamida y adenina, o NAD(P)H, es un cofactor metabólico y transportador de electrones que se encuentra en todo el citoplasma, cuya función es crucial en la glucólisis y en la ruta de la pentosa fosfato. Puesto que es un componente crucial del metabolismo celular, la autofluorescencia de NAD(P)H está presente en casi todas las células vivas. Para llevar a cabo sus funciones metabólicas, la molécula existe naturalmente en estado oxidado (NAD+) y reducido (NAD(P)H). Sin embargo, solo el estado NAD(P)H produce fluorescencia. Su equivalente oxidado, NAD+, no es fluorescente. Excitación: 340 nm. Emisión: 450 nm. (Fuentes: Chance et al. 1979; Georgakoudi et al. 2002).
2. Flavinas
Esta coenzima metabólica, que se encuentra comúnmente en forma de dinucleótido de adenina flavina (FAD), desempeña funciones importantes en el ciclo del TCA y en la cadena de transporte de electrones. Se encuentra principalmente en las mitocondrias, donde los procesos metabólicos activos producen puntos críticos de señal autofluorescente. Algunos investigadores prefieren referirse a la autofluorescencia de las flavinas como «fluorescencia de flavoproteínas», ya que la FAD está ligada funcionalmente a complejos proteicos en las mitocondrias como el succinato deshidrogenasa. En una situación opuesta al estado NAD(P)H, solo la forma oxidada de la FAD produce fluorescencia, mientras que la forma reducida no lo hace. Excitación: 380 nm. Emisión: 520–560 nm. (Fuentes: Chance et al. 1979; Deyl et al. 1980).
3. Colágeno
El colágeno es una proteína mecánica clave que puede ser ensamblada para crear varias matrices estructurales de soporte destinadas la mayoría de los tejidos. Puede encontrarse en la dermis de la piel, la matriz extracelular de los órganos internos y la vasculatura circundante. Comprende tendones, ligamentos, cabello y uñas también. Si bien el colágeno rara vez es observado en cultivos celulares, los investigadores que utilizan muestras in vivo o tejidos completos para sus experimentos de procesamiento de imágenes probablemente encontrarán que el colágeno es inevitable. Excitación: 270 nm. Emisión: 390 nm. (Fuente:Georgakoudi et al. 2002).
4. Elastina
La elastina, otra proteína prominente de la matriz extracelular (ECM), a menudo se entremezcla con el colágeno para dar a las matrices extracelulares una mayor extensibilidad mecánica. La elastina está densamente ubicada alrededor de la vasculatura que experimenta frecuentes deformaciones elásticas para hacer frente a los cambios en la presión arterial. También se encuentra en la piel donde la flexibilidad es necesaria a fin de complementar el movimiento de los huesos y músculos subyacentes. Una vez más, los investigadores que procesan imágenes de muestras in vivo o de tejidos completos deben ser conscientes de la autofluorescencia causada por proteínas estructurales como la elastina. Excitación: De 350 a 450 nm; Emisión: De 420 a 520 nm. (Source: Deyl et al. 1980).
5. Lipofuscina
La lipofuscina, una molécula autofluorescente bastante confusa, puede encontrarse incluyendo estructuras pequeñas pero vibrantes en los espectros de fluorescencia de las neuronas, las células gliales, las células del músculo esquelético, las células del músculo cardíaco, entre otras. La lipofuscina puede ser reconocida tanto en cultivos celulares como en tejidos completos. Se ha observado que se vuelve progresivamente más evidente a medida que una muestra experimenta envejecimiento biológico. Si bien el nombre puede suponer que un lípido o lipoproteína es el responsable, la señal de autofluorescencia de la lipofuscina se ha atribuido a una amalgama de proteínas, carbohidratos y lípidos. Excitación: De 345 a 490 nm. Emisión: De 460 a 670 nm. (Fuente: Billinton y Knight 2001).
6. Triptófano
El triptófano, un aminoácido esencial y un precursor requerido para moléculas señalizadoras como la serotonina y la melatonina que pueden encontrarse en la investigación neurológica, es un componente básico de la biosíntesis proteica. Su omnipresencia no puede subestimarse, ya que los residuos de triptófano pueden encontrarse en la mayoría de las proteínas plegadas y su señal de autofluorescencia penetra posteriormente en células y tejidos por igual. Puesto que su química estructural está ligada a las conformaciones proteicas, se ha observado que la autofluorescencia del triptófano cambia en longitud de onda e intensidad según los cambios que se dan en la estructura de la proteína y el estado de unión. Excitación: 280 nm. Emisión: 350 nm. (Fuente: Ghisaidoobe y Chung 2014).
7. Melanina
La melanina es un pigmento natural que contribuye a la coloración de la piel, el cabello y los ojos. La melanina, producida por las células de la epidermis basal de la piel, actúa como una molécula fotoprotectora que evita que la luz ultravioleta del sol dañe las valiosas proteínas y el ADN de las células de la piel expuestas hacia el exterior. A menos que esté cultivando melanocitos directamente, la melanina requiere el mayor tratamiento para los experimentos que generan imágenes a través de la piel, ya que su concentración y distribución naturales pueden variar incluso dentro de las mismas muestras. Excitación: De 340 a 400 nm. Emisión: De 360 a 560 nm. (Fuente: Gallas y Eisner 1987).
Fluorescencia a partir de la preparación de muestras
Las fuentes anteriores irradian fotones de forma natural a partir de tejidos biológicos. Muchos investigadores también encuentran fluorescencia en componentes o reactivos no biológicos necesarios para preparar muestras en laboratorio.
Por ejemplo, los fondos plásticos de las placas de Petri, las placas de pocillos y los matraces/frascos dedicados al cultivo celular pueden presentar una fluorescencia intensa y de amplio espectro. Se recomienda usar recipientes con fondo de vidrio o polímeros no fluorescentes de forma específica siempre que se requiera procesar imágenes de fluorescencia a partir de muestras biológicas. Por otra parte, el rojo de fenol, un aditivo común para los medios de cultivo celular, también puede aumentar significativamente la fluorescencia de fondo cuando se procesan imágenes de células vivas. Esto puede evitarse fácilmente al cambiar su medio a una alternativa sin rojo de fenol antes de comenzar cualquier experimento de procesamiento de imágenes.
Las etiquetas o pegatinas de papel pueden causar problemas similares, ya que el papel es muy fluorescente. Cuando use etiquetas de papel en recipientes o portaobjetos, mantenga las etiquetas fuera del camino de las muestras que ha seleccionado para adquirir imágenes.
Por último, los fijadores de aldehído se usan comúnmente en protocolos de coloración o tinción. Los reactivos como el glutaraldehído o el formaldehído reaccionan con las proteínas para crear enlaces cruzados fluorescentes en las células y los tejidos. Reemplácelos con fijadores sin aldehído para evitar una acumulación de señal de fluorescencia indeseada.
Si bien estos ejemplos no son fuentes naturales de autofluorescencia, comprender su origen e impacto puede evitar efectos indeseados en los datos de la imagen.
¿Cómo manejar la autofluorescencia indeseada en un experimento de procesamiento de imágenes?
Hasta la fecha se han determinado algunos autofluorocromos y su ubicación. Pero, surge una pregunta. ¿Cómo se controlan estas señales antes de iniciar experimentos de procesamiento de imágenes?
En el caso de tejidos simples o cultivos monocelulares, seleccione diligentemente los espectros de excitación y emisión de las tinciones comerciales, y busque filtros angostos auxiliares que eviten picos importantes de autofluorescencia. Al efectuar esto, podrá aumentar en gran medida su relación señal-ruido.
Si su protocolo lo permite, elija tinciones de elevada eficiencia cuántica o experimente con mayores concentraciones de agente de contraste. Esto también puede aumentar la señal, aunque a un costo más alto. Las estrategias modernas aplican luz de excitación en el infrarrojo cercano (NIR) con un marcado excitable a más de 700 nm (p. ej., Cy7 o Alexa Fluor 750); esto con el fin de evitar las bandas de excitación y emisión de los autofluorocromos que se encuentran con frecuencia (Figura 2).
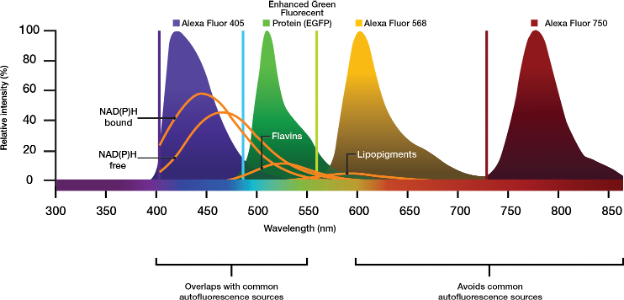
Figura 2. Picos de emisión de los fluorocromos comerciales Alexa relativos a las moléculas autofluorescentes comunes a partir de un procesamiento de imágenes biológico. Seleccionar agentes de contraste que exciten y emitan en la banda NIR permite evitar emisiones indeseadas de los contribuidores autofluorescentes.
Si la flexibilidad puede tomarse en cuenta, estudie si las modalidades alternativas de procesamiento de imágenes podrían funcionar con sus experimentos. En el caso de muestras o tejidos gruesos, los sistemas de microscopía confocal o multifotónica permiten minimizar la contribución global de autofluorescencia. Estos eliminan la acumulación de luz desenfocada o limitan la excitación al plano focal, respectivamente.
Ciertas técnicas, como el procesamiento de imágenes con bioluminiscencia, eliminan por completo la posibilidad para que los autofluorocromos puedan contribuir mediante la señal en los datos recopilados. Los experimentos de luminiscencia no requieren luz de excitación para que las reacciones quimioluminiscentes produzcan fotones de emisión; por lo tanto, los autofluorocromos no reciben estimulación.
Cuando la contribución de la señal de autofluorescencia no puede ser mitigada antes del procesamiento de imágenes, es posible que técnicas de imagen sucesivas a la adquisición, como la separación espectral o la sustracción de fondo, sean alternativas eficaces. Estas técnicas de cálculo requieren que los investigadores eliminen los fluocromos endógenos de sus muestras, o que tengan un conocimiento previo sobre los espectros de autofluorescencia para eliminar la contribución de manera efectiva.


