Verificar el marcado tumoral de una novedosa nanosonda fluorescente mediante el procesamiento de imágenes con NIR
El procesamiento de imágenes con fluorescencia (FLI) es usado en una diversidad de técnicas de procesamiento de imágenes biomédicas en entornos preclínicos y clínicos gracias a las ventajas que ofrece, como la alta resolución espacial y temporal, la alta sensibilidad de detección, el tiempo de respuesta rápido y la buena operabilidad. Análogamente, aplicar las capacidades del infrarrojo cercano (NIR) al procesamiento de imágenes con fluorescencia aporta sus propias ventajas de observación profunda, baja fototoxicidad y baja interferencia con respecto a la autofluorescencia del tejido. Fruto de ello, el procesamiento de imágenes de fluorescencia con NIR se ha convertido en una técnica popular en la investigación médica, en especial para el tratamiento de tumores.
Procesamiento de imágenes de fluorescencia mediante excitación de la zona NIR-II
En comparación con los marcadores fluorescentes tradicionales, como las proteínas fluorescentes y los colorantes, las nanosondas fluorescentes pueden lograr un procesamiento de imágenes por excitación del NIR al ajustar su composición química y su tamaño morfológico. Asimismo, las nanosondas fluorescentes pueden seguir una modificación dedicada a la localización, la administración de fármacos/medicamentos y la detección multimodal.
Hasta hoy, los investigadores han estudiado una variedad de sondas fluorescentes para poder satisfacer la creciente demanda en cuestión de probabilidades para el diagnóstico y el tratamiento precisos de enfermedades. Pero aún, la mayoría de las sondas fluorescentes convencionales emiten en la zona visible o NIR-I (400–1000 nm). Esto limita en gran medida su aplicación en el procesamiento de imágenes biomédicas debido a ciertos inconvenientes, como la poca profundidad de penetración en el tejido y la baja resolución espacial.
No obstante, los recientes estudios demuestran una expansión del procesamiento de imágenes con fluorescencia hasta la zona NIR-II (1000–1700 nm). Esto manifiesta el gran potencial de la observación de tejidos en profundidad, como la alta sensibilidad y claridad, debido a las propiedades de baja dispersión de luz y la baja autofluorescencia en el procesamiento de imágenes. Por ende, este método puede proporcionar información crucial in vivo que no puede revelarse fácilmente mediante el procesamiento de imágenes de fluorescencia convencional.
Si bien la tecnología para el procesamiento de imágenes con fluorescencia continúa evolucionando, es difícil adaptar perfectamente los métodos de procesamiento óptico a modalidad única con los requisitos actuales de detección in vivo, profunda, ultrasensible, 3D y de alta resolución espacial y temporal. Por consiguiente, hay una urgencia por desarrollar sistemas de detección óptica multimodal.
Combinar los métodos de la imaginería biomédica para mejorar la precisión del procesamiento de imágenes
La imagen fotoacústica (PAI) es un método de imaginería biomédica que ha sido desarrollado en los últimos años. Cuando un láser emitido se irradia en los tejidos biológicos, la señal del ultrasonido que se genera a partir de los tejidos biológicos transporta información sobre las características de absorción de luz de dichos tejidos. Como resultado, el procesamiento de imágenes a modalidad dual, que combina el procesamiento de fluorescencia (FLI) con NIR-II y la imagen fotoacústica (PAI) con NIR-I, y cuyas ventajas se compensan entre sí, puede mejorar efectivamente la precisión de las imágenes. Asimismo, presenta un gran potencial aplicativo para un diagnóstico eficiente.
Para lograr un procesamiento de imágenes de alta calidad, el diseño de la sonda es particularmente importante. Las moléculas con estructuras donante-receptor-donante (DAD) han captado mucha atención en el diseño molecular en la segunda zona del infrarrojo cercano (NIR-II) debido a su excelente biocompatibilidad, estructuras químicas bien definidas y propiedades ópticas personalizables. Para obtener la emisión en la zona NIR-II, se usó de forma más amplia la unidad fuertemente deficiente en electrones, benzo[1,2-c:4,5-c']bis([1,2,5]tiadiazol (BBTD), como receptor (Figura 1a).
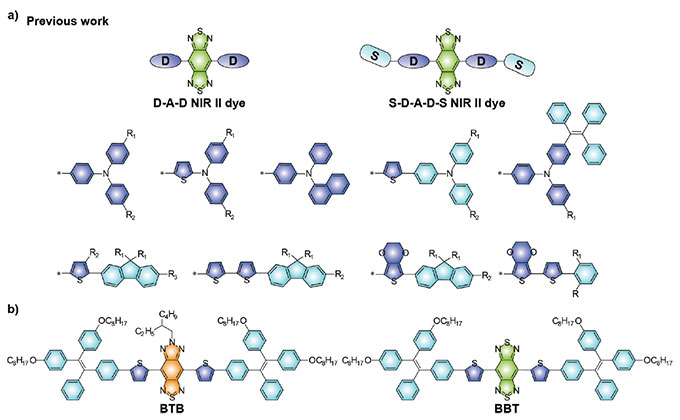
Figura 1. (a) Moléculas representativas fluorescentes de tipo D-A-D en la zona NIR-II basadas en receptores BBTD. (b) Estructuras químicas de la molécula fluorescente BTB y la molécula fluorescente de control BBT en la zona NIR-II mencionadas en este artículo.
Los rendimientos cuánticos (QY) de las moléculas fluorescentes con una estructura D-A-D en NIR-II son relativamente bajos debido a la presencia de fuertes efectos de transferencia de carga intramolecular (ICT). Para mejorar los QY, se han desarrollado muchas estrategias. Estas estrategias comprenden la vinculación de colorantes con estructuras hidrofóbicas de proteínas, la construcción de fluorocromos con propiedades de emisión inducida por agregación, la introducción de unidades de protección en estructuras moleculares y el diseño de moléculas antirotura.
Sin embargo, los QY de la mayoría de las moléculas fluorescentes en la zona NIR-II, que se han dado a conocer con estructuras D-A-D, siguen siendo relativamente bajos debido a los efectos inherentes de la ICT. Además, los receptores BBTD requiere condiciones de síntesis relativamente severas. Esto limita el desarrollo de las moléculas fluorescentes más avanzadas en la zona NIR-II por funcionalización. Por lo tanto, es importante estudiar nuevas unidades receptoras con el fin de proporcionar más estrategias de diseño alternativas que permitan ampliar la aplicación de moléculas fluorescentes en la zona NIR-II.
Requisitos técnicos para el procesamiento de imágenes a partir de sonda fluorescente con NIR
La detección in vitro/in vivo de sondas multimodales con NIR también plantea nuevos desafíos para los instrumentos de procesamiento de imágenes. En comparación con el procesamiento de imágenes confocal convencional, el procesamiento de imágenes a partir de sondas fluorescente con NIR deben cumplir los siguientes requisitos técnicos:
- La mayoría de los microscopios confocales convencionales cuentan con longitudes de onda de excitación entre 400 y 650 nm. El procesamiento de imágenes con NIR requiere láseres NIR con longitudes de onda >700 nm.
- Los componentes ópticos destinados al procesamiento de imágenes convencional (p. ej., el resonador de escaneo, la lente del objetivo y la rejilla) se hallan, en su mayoría, sólo en el rango visible para la transmisión/calibración. Esto no permite garantizar la eficiencia ni la precisión del procesamiento de imágenes con el NIR.
- La detección con el NIR requiere un detector dedicado para >750 nm de NIR. Los detectores ordinarios poseen una eficiencia de detección muy baja en la zona NIR.
Novedosa nanosonda fluorescente para imágenes fotoacústicas y de fluorescencia en NIR-II
La colaboración entre el grupo del Dr. Li Kai de SUSTech, el grupo del Dr. Liu Jie de la Universidad Tecnológica de Nanjing y el grupo del Dr. Chen Hao del Instituto de Ciencias Farmacéuticas de Shanghai (Academia de Ciencias de China), ha dado como frutos una estrategia de diseño molecular de ingeniería de receptores para obtener sondas fluorescentes en la zona NIR-II dotadas de altos coeficientes de absorbancia y rendimientos cuánticos (Figura 1b). Esta estrategia ha permitido usar sondas funcionalizadas para una detección dirigida a los tumores bajo condiciones de modo bidimensional y tridimensional.
El 10 de noviembre de 2021, los resultados del estudio fueron publicados en línea a través de la Revista Materials Chemistry B, en un artículo titulado «Receptor Engineering of Small Molecule Fluorophores for NIR-II Fluorescent and Photoacoustic Imaging» [Ingeniería de receptores de fluorocromos de moléculas pequeñas para imágenes fotoacústicas y fluorescentes en NIR-II].
Se entrevistó al Dr. Yaxi Li, uno de los autores del artículo mencionado previamente, para que nos comparta los descubrimientos principales y la evolución de la experiencia general de la investigación:
1. ¿Cuáles son las ventajas de la nueva nanosonda fluorescente en la imagenería biomédica?
Las sondas fluorescentes convencionales no tienen como diana al tumor en sí y, a menudo, se mantienen en los sitios del tumor por el efecto de retención y permeabilidad mejorada (EPR), lo que las hace aplicables para el procesamiento de imágenes de tumores in vivo. Sin embargo, este enfoque de enriquecimiento pasivo requiere un cierto tamaño de nanopartículas y, a menudo, es ineficiente. Por lo tanto, para aumentar el enriquecimiento de las sondas fluorescentes en las áreas cancerosas y mejorar el efecto del procesamiento imagen para un diagnóstico in vivo de alta precisión, se modificó la superficie de la nanosonda con el péptido diana de arginina-glicina-ácido aspártico (RGD) a fin de obtener las nanosondas BTB-RGD.
Tal y como se ilustra en la Figura 2a, el ratón representativo e inoculado con las nanosondas (NP) BTB-RGD en la vena de la cola, mostró tras 48 horas un aumento significativo de la señal de fluorescencia con NIR-II en el área del tumor, y la señal alcanzó el valor máximo a las 48 horas. En cambio, un ratón de control inoculado con las nanosondas BTB sin capacidad diana, mostró sólo un aumento débil en la señal de fluorescencia en el área del tumor. El análisis cuantitativo (Figura 2b) mostró que las señales provenientes del área tumoral del ratón, inoculado con las nanosondas BTB-RGD, siempre fueron más altas que las del grupo de control.
De forma paralela al procesamiento de imágenes de fluorescencia, se usó la tomografía fotoacústica (PAT) para confirmar aún más el efecto de orientación general de las nanosondas BTB-RGD en las áreas del tumor (Figura 2c). La intensidad de la señal fotoacústica en las áreas tumorales del ratón, inoculado con las nanosondas BTB-RGD, también fue más alta que la del ratón tratado con el grupo de control, según los resultados del procesamiento de fluorescencia con NIR-II.
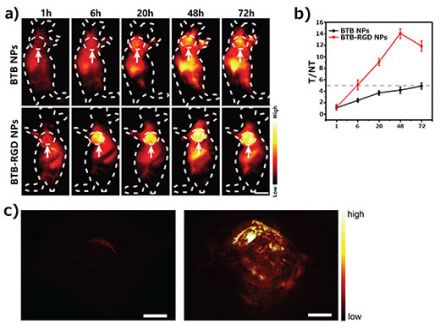
Figura 2. (a) Imágenes representativas del procesamiento de fluorescencia con NIR-II en ratones portadores de tumores 143B tras 72 horas desde la inoculación de la nanosonda BTB-RGD o la BTB usando una excitación con láser de 808 nm (140 mW/cm-2) y filtro de paso largo de 1000 nm. Las flechas indican tumores subcutáneos. Cantidad de ratones por grupo (n) = 4. Barra de escala = 5 mm. (b) Relación T/NT del tumor 143B procesada en imagen durante 72 horas. Los datos son representados en la media ± SD, n = 4. (c) Imágenes fotoacústicas tridimensionales de tumores 143B (excitación de 730 nm) en ratones portadores tras 48 horas desde la inoculación de la nanosonda BTB (izquierda) o BTB-RGD (derecha). Barra de escala = 2 mm.
El resultado de este procesamiento de imágenes demuestra satisfactoriamente el enorme potencial de las nanosondas fluorescentes en las aplicaciones de procesamiento de imágenes biológicas a modo dual. Por un lado, la alta sensibilidad del procesamiento de imágenes de fluorescencia en la zona NIR-II desempeñó con éxito un claro procesamiento bidimensional de imágenes en los márgenes del tumor. Por otra parte, frente al procesamiento de imágenes de fluorescencia, la PAI otorga una resolución temporal y una sensibilidad relativamente más bajas; sin embargo, puede proporcionar una resolución espacial y una visualización 3D superiores.
Este enfoque de procesamiento de imágenes dual facilitará la reconstrucción de imágenes volumétricas de tejidos tumorales, lo cual es muy valorado en las aplicaciones traduccionales (o traslacionales) clínicas. Por ejemplo, los médicos pueden evaluar la información volumétrica 3D del tejido tumoral y ejecutar un procesamiento de imágenes fluoroscópico en vista de extirpar quirúrgicamente el tumor gracias a la guía de una sola dosis de agente de contraste. Por lo tanto, la integración de estas dos modalidades de imagen a partir de un solo agente de contraste ofrece enormes oportunidades para el procesamiento de imágenes vasculares precisas y el tratamiento del cáncer.
2. ¿Qué dificultades técnicas se encontró al procesar imágenes en la zona NIR? ¿Cómo se resolvieron?
Para demostrar la capacidad diana de las nanosondas BTB-RGD, primero se requirió determinar la capacidad diana en las células tumorales a través de ensayos celulares. Para ello, se precisó el uso de la microscopía confocal. Sin embargo, la mayoría de los microscopios confocales convencionales se dotan de láseres limitados a la región visible. Por consiguiente, para validar la sonda en la diana de zona NIR-II, el grupo sólo pudo demostrar indirectamente la capacidad diana al reemplazar la sonda con una estructura similar en la región visible. Sin embargo, este enfoque no puede demostrar visualmente la capacidad diana de la propia sonda en la zona NIR-II. Además, aumenta la carga de trabajo con respecto a la preparación de la sonda durante el experimento.
Por ende, un microscopio confocal dotado de un láser NIR es particularmente importante. Para hacer frente a esta dificultad, se usó un microscopio confocal de escaneo láser FLUOVIEW™ FV3000 actualizado con la solución de procesamiento de imágenes en el infrarrojo cercano (NIR) FV3000 Red. El uso del sistema FV3000 Red, permitió determinar con éxito la capacidad diana de las nanosondas BTB-RGD en las células tumorales. La Figura 3 muestra que, tras la incubación con sólo las nanosondas BTB-RGD de 40 μg mL-1, la señal de fluorescencia de las células cancerosas fue significativamente mayor que la del grupo de nanosondas de control BTB. En cambio, la intensidad de fluorescencia de las células 3T3 normales incubadas con las nanosondas BTB-RGD no difirió significativamente de las del tratamiento con las nanosondas BTB. Estos resultados indican que las nanopartículas, tras la funcionalización con el péptido diana RGD, pueden impulsar la capacidad diana a las células tumorales que sobreexpresan la integrina αvβ3.
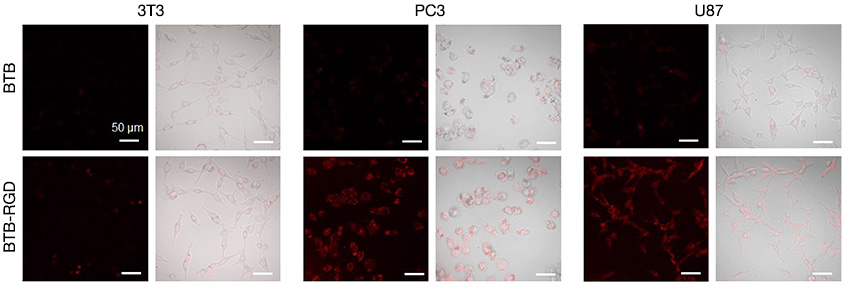
Figura 3. Imágenes confocales de células 3T3, PC3 y U87 después de la incubación con nanosondas BTB-RGD de 40 μg/mL-1 durante 4 horas. Longitud de onda de excitación: 730 nm. Filtro: 760–890 nm. Barra de escala = 50 μm.
En experimentos anteriores, el marcado de tumores sólo pudo confirmarse indirectamente. Esto se ejecutó mediante el reemplazo de la sonda por una estructura similar en el rango visible, ya que el rango de observación del sistema estaba limitado sólo a la luz visible. En este experimento, el sistema FV3000 Red permitió medir con éxito el marcado de las nanosondas BTB-RGD en células tumorales sin reemplazar la sonda.
Soluciones del infrarrojo cercano (NIR) para la microscopía confocal
El sistema FV3000 Red amplía las capacidades de detección de longitud de onda del microscopio FV3000 en la zona del NIR. Al actualizar cada módulo de procesamiento de imágenes a la detección del NIR (como el láser, la óptica, la lente del objetivo y el detector), el sistema FV3000 Red proporciona una solución especializada para un procesamiento de imágenes multicolores con NIR más sensible y preciso.
Características del sistema FV3000 Red:
|
| AgradecimientosEsta nota de aplicación ha sido elaborada con la ayuda del siguiente investigador: Dr. Kai Li, Universidad de Ciencia y Tecnología del Sur |
Referencias: (1.) V. J. Yao, S. D’Angelo, K. S. Butler, C. Theron, T. L. Smith, S. Marchio, J. G. Gelovani, R. L. Sidman, A. S. Dobraff, C. J. Brinker, A. R. M. Bradbuty, W. Arap. y R. Pasqualini, Ligandtargeted theranostic nanomedicines against cancer [Trad. aprox. Nanomedicinas teranósticas orientadas a ligandos selectivos contra el cáncer], J. Control. Release 2016, 240, 267-286. (2.) B. Guo, Z. Sheng, D. Hu, C. Liu, H. Zheng, B. Liu, Through Scalp and Skull NIR-II Photothermal Therapy of Deep Orthotopic Brain Tumors with Precise Photoacoustic Imaging Guidance [Trad. aprox. Terapia fototérmica con NIR-II a través del cuero cabelludo y el cráneo para tumores cerebrales ortotópicos profundos mediante una guía precisa de imágenes fotoacústicas], Adv. Mater. 2018, 30, 1802591. (3.) G. L. Bagnato, N. Irrera, G. Pizzino, D. Santoro, W. N. Roberts, G. Bagnato, G. Pallio, M. Vaccaro, F. Squadrito, A. Saitta, D. Altavilla, y A. Bitto, Dual αvβ3 and αvβ5 blockade attenuates fibrotic and vascular alterations in a murine model of systemic sclerosis [Trad. aprox. Bloqueo dual de αvβ3 y αvβ5 que atenúa las alteraciones fibróticas y vasculares en un modelo murino de esclerosis sistémica], Clin. Sci. 2018, 132, 231-242. (4.) N. Zoppi, N. Chiarelli, V. Cinquina, M. Ritelli, y M. Colombi, GLUT10 deficiency leads to oxidative stress and non-canonical αvβ3 integrin-mediated TGFβ signalling associated with extracellular matrix disarray in arterial tortuosity syndrome skin fibroblasts [Trad. aprox. Deficiencia de la proteína GLUT10 que conduce al estrés oxidativo y a la señalización TGFβ no canónica por mediación de integrina αvβ3 y que se asocia a la desorganización de la matriz extracelular en los fibroblastos de la piel por el síndrome de tortuosidad arterial], Hum. Mol. Genet. 2015, 24, 6769-6787. (5.) Y. Li, Z. Li, D. Hu, S. Wang, M. Zha, S.-B. Lu, Z. Sheng, y K. Li, Targeted NIR-II emissive nanoprobes for tumor detection in mice and rabbits [Trad. aprox. Nanosondas emisoras en NIR-II dedicadas a la detección de tumores en ratones y conejos], Chem. Commun. 2021, 57, 6420-6423.
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.

