Vérification du marquage tumoral par une nouvelle nanosonde fluorescente au moyen de l’imagerie proche infrarouge
L’imagerie de fluorescence est largement utilisée dans le cadre de diverses techniques d’imagerie biomédicale en contextes précliniques et cliniques, et ce, grâce aux avantages qu’elle apporte, à savoir des résolutions spatiale et temporelle élevées, une haute sensibilité de détection, un temps de réponse rapide et une bonne exploitabilité. L’application du proche infrarouge (NIR) à l’imagerie de fluorescence apporte ses propres avantages : observation en profondeur, faible phototoxicité et faible interférence avec l’autofluorescence des tissus. En conséquence, l’imagerie de fluorescence NIR est devenue une technique prisée en recherche médicale, en particulier dans le traitement des tumeurs.
Imagerie de fluorescence dans le domaine du NIR-II
Comparativement aux marqueurs fluorescents classiques, comme les protéines fluorescentes et les fluorophores, les nanosondes fluorescentes peuvent facilement être adaptées pour l’imagerie avec excitation en proche infrarouge par l’ajustement de leur composition chimique et de leur taille morphologique. De plus, les nanosondes fluorescentes peuvent être modifiées encore davantage à des fins de localisation, d’administration de médicaments et de détection multimodale.
Jusqu’à présent, les chercheurs ont exploré diverses sondes fluorescentes pour répondre à la demande croissante d’outils capables de renforcer la précision du diagnostic et du traitement de certaines maladies, mais la plupart de ces sondes fluorescentes classiques émettent dans le spectre visible ou dans le domaine du NIR-I (400-1000 nm). Cela limite considérablement leur utilisation en imagerie biomédicale en raison d’inconvénients comme la faible profondeur de pénétration dans les tissus et la faible résolution spatiale.
De récentes études ont toutefois montré que l’imagerie de fluorescence peut maintenant aller jusque dans le domaine du NIR-II (1000-1700 nm). En raison de ses propriétés de faible diffusion de la lumière et de faible autofluorescence pour l’imagerie, l’imagerie de fluorescence dans le NIR-II présente un grand potentiel pour l’observation des tissus profonds, notamment en offrant une excellente sensibilité et une grande clarté. Cette méthode peut donc fournir des informations cruciales in vivo difficiles à révéler à l’aide de l’imagerie de fluorescence classique.
Bien que la technologie d’imagerie de fluorescence continue d’évoluer, il est difficile d’adapter parfaitement les méthodes d’imagerie optique monomodales seules aux exigences actuelles de la détection in vivo, profonde, ultrasensible, 3D et à haute résolution spatiale et temporelle. Il est donc urgent de mettre au point des systèmes de détection optique multimodaux.
Combiner des méthodes de bioimagerie pour améliorer la précision des images
L’imagerie photoacoustique est une méthode d’imagerie biomédicale non destructive mise au point ces dernières années. Lorsque des tissus biologiques sont irradiés avec un laser pulsé, le signal ultrasonore généré par les tissus biologiques contient des informations sur les caractéristiques d’absorption de la lumière des tissus. Ainsi, l’imagerie à double modalité, qui combine l’imagerie de fluorescence NIR-II et l’imagerie photoacoustique NIR-I et qui utilise les avantages de chacune de ces deux techniques tout en compensant leurs faiblesses respectives, peut améliorer efficacement la précision de l’imagerie. Elle a également un grand potentiel en matière d’applications aptes à améliorer l’efficacité des diagnostics.
Pour produire une imagerie de haute qualité, la conception de la sonde est particulièrement importante. Les molécules ayant des structures donneur-accepteur-donneur (DAD) ont beaucoup attiré l’attention pour la conception de molécules pour l’imagerie NIR-II en raison de leur excellente biocompatibilité, de leurs structures chimiques bien définies et de leurs propriétés optiques adaptables. Pour obtenir l’émission dans le NIR-II, l’unité fortement déficiente en électrons, soit le benzo[1,2-c:4,5-c’]bis([1,2,5]thiadiazole (BBTD), a été la plus largement utilisée comme accepteur (figure 1a).
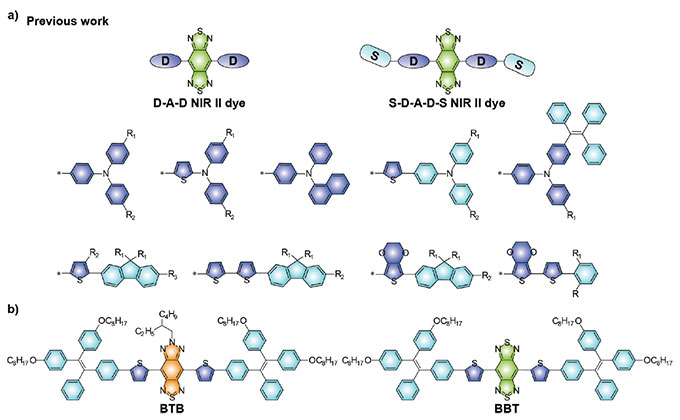
Figure 1. (a) Molécules fluorescentes dans le NIR-II de type DAD représentatives basées sur les récepteurs BBTD.
(b) Structures chimiques des molécules fluorescentes dans le NIR-II BTB et des molécules fluorescentes témoins BBT, telles que décrites dans l’article mentionné plus bas.
Les rendements quantiques des molécules fluorescentes dans le NIR-II avec une structure DAD sont relativement faibles en raison des forts effets de transfert de charge intramoléculaire présents. De nombreuses stratégies ont été développées pour améliorer les rendements quantiques. Ces stratégies comprennent la liaison à des fluorophores ayant des structures de protéines hydrophobes, l’élaboration de fluorophores ayant des propriétés d’émission induite par agrégation, l’introduction d’unités de protection dans les structures moléculaires et la conception de molécules anti-éclatement.
Toutefois, les rendements quantiques de la plupart des molécules fluorescentes dans le NIR-II avec structures DAD décrites sont encore relativement faibles en raison de leurs effets de transfert de charge intramoléculaire inhérents. De plus, le BBTD nécessite des conditions de synthèse relativement rigoureuses. Cela limite le développement par fonctionnalisation de molécules fluorescentes dans le NIR-II plus avancées. Par conséquent, l’exploration de nouvelles unités de récepteur est importante pour développer de nouvelles stratégies de conception pour l’application à grande échelle des molécules fluorescentes dans le NIR-II.
Exigences techniques de l’imagerie de sondes fluorescentes dans le NIR
La détection in vitro/in vivo des sondes multimodales NIR pose aussi de nouveaux défis pour les appareils d’imagerie. Par rapport à l’imagerie confocale classique, l’imagerie des sondes fluorescentes dans le NIR doit répondre aux exigences techniques suivantes :
- La plupart des microscopes confocaux classiques ont des longueurs d’onde d’excitation comprises entre 400 nm et 650 nm. L’imagerie NIR nécessite des lasers NIR avec des longueurs d’onde supérieures à 700 nm.
- Les composants optiques d’imagerie classiques (p. ex. le résonateur de balayage, l’objectif et le réseau) ne fonctionnent pour la plupart que dans le spectre visible en ce qui concerne la transmission et la correction des aberrations. L’efficacité et la précision de l’imagerie NIR ne peuvent donc pas être garanties.
- La détection des signaux dans le NIR requiert un détecteur spécial capable de détecter des longueurs d’onde supérieures à 750 nm. Les détecteurs ordinaires ont une efficacité de détection très basse dans le domaine du NIR.
Nouvelle nanosonde fluorescente pour l’imagerie de fluorescence NIR-II et l’imagerie photoacoustique
Les groupes du Dr Li Kai au SUSTech, du Dr Liu Jie à la Nanjing University of Technology, et du Dr Chen Hao au Shanghai Institute of Pharmaceutical Sciences de la Chinese Academy of Sciences ont uni leurs forces pour proposer une stratégie de conception moléculaire pour l’ingénierie des récepteurs pour obtenir des sondes fluorescentes dans le NIR-II ayant des coefficients d’absorbance et des rendements quantiques élevés (figure 1b). Cette stratégie a permis l’obtention de sondes fonctionnalisées permettant la détection ciblée de tumeurs dans des conditions de modes bidimensionnel et tridimensionnel.
Le 10 novembre 2021, les résultats de l’étude ont été publiés en ligne dans le Journal of Materials Chemistry B, dans un article intitulé « Receptor Engineering of Small Molecule Fluorophores for NIR-II Fluorescent and Photoacoustic Imaging ».
Nous avons demandé à la Dre Yaxi Li, qui fait partie des principaux auteurs de l’article, de nous indiquer les principales conclusions de l’étude et de partager son expérience globale de recherche :
1. Quels sont les avantages de la nouvelle nanosonde fluorescente pour la bioimagerie ?
Les sondes fluorescentes classiques ne ciblent pas la tumeur elle-même, mais sont souvent retenues au niveau des sites tumoraux par l’effet de perméabilité et de rétention accrues (effet EPR), ce qui permet leur utilisation pour l’imagerie in vivo des tumeurs. Toutefois, cette approche d’enrichissement passif nécessite une certaine taille de nanoparticules et est souvent inefficace. Par conséquent, afin d’augmenter l’enrichissement des sondes fluorescentes au niveau des sites tumoraux et d’améliorer l’imagerie pour effectuer des diagnostics in vivo très précis, nous avons modifié la surface de la nanosonde avec le peptide de ciblage Arg-Gly-Asp (RGD), ce qui a permis l’obtention de nanosondes à nanoparticules BTB-RGD.
Comme illustré à la figure 2a, la souris étudiée ayant reçu une injection de nanoparticules BTB-RGD par la veine caudale pendant 48 heures a présenté une augmentation considérable du signal de fluorescence NIR-II au site tumoral, et ce signal a atteint son maximum après 48 heures. En comparaison, une souris témoin ayant reçu une injection de nanoparticules BTB sans capacité de ciblage n’a montré qu’une faible augmentation du signal de fluorescence au site tumoral. L’analyse quantitative (figure 2b) a montré que les signaux au site tumoral d’une souris ayant reçu une injection de nanoparticules BTB-RGD étaient toujours plus forts que ceux du groupe témoin.
En plus de l’imagerie de fluorescence, nous avons utilisé la tomographie photoacoustique pour confirmer davantage l’effet de ciblage global des nanoparticules BTB-RGD vers les sites tumoraux (figure 2c). L’intensité du signal photoacoustique au site tumoral de la souris ayant reçu une injection de nanoparticules BTB-RGD était également supérieure à celle du signal de la souris témoin, ce qui est concordant avec les résultats de l’imagerie de fluorescence NIR-II.
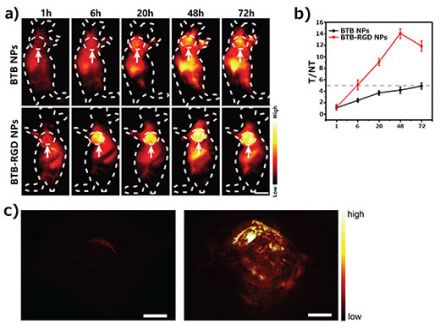
Figure 2. (a) Imagerie de fluorescence NIR-II de souris porteuses de tumeurs 143B effectuée 72 heures après l’injection de nanoparticules BTB-RGD ou BTB sous une excitation avec un laser de 808 nm (140 mW cm-2) ; filtre : passe-long de 1000 nm. Les flèches indiquent les tumeurs sous-cutanées. Nombre de souris par groupe (n) = 4. Échelle graphique : 5 mm. (b) Rapport T/NT (tumeur/sans tumeur) pour une
tumeur 143B imagée pendant 72 heures. Les données sont représentées en tant que
moyenne ± écart-type, n = 4. (c) Images photoacoustiques tridimensionnelles de tumeurs 143B (excitation à 730 nm) chez des souris 48 heures après l’injection de nanoparticules BTB (à gauche) et BTB-RGD (à droite). Échelle graphique : 2 mm.
Ces résultats d’imagerie illustrent le fort potentiel de nos sondes fluorescentes conçues pour les applications de bioimagerie bimodale. D’une part, la haute sensibilité de l’imagerie de fluorescence NIR-II a été utilisée avec succès pour obtenir des images bidimensionnelles claires des marges tumorales. D’autre part, par rapport à l’imagerie de fluorescence, la tomographie photoacoustique a une résolution temporelle et une sensibilité relativement inférieures, mais peut fournir une résolution spatiale et une visualisation 3D supérieures.
Cette approche à double imagerie facilitera la reconstruction d’images volumétriques de tissus tumoraux, ce qui est très recherché dans les applications cliniques translationnelles. Par exemple, les médecins peuvent évaluer les informations de volume 3D du tissu tumoral et effectuer une imagerie fluoroscopique pour l’ablation chirurgicale de la tumeur avec une seule dose de produit de contraste. Ainsi, l’intégration de ces deux modalités d’imagerie avec un seul produit de contraste offre d’énormes possibilités pour l’amélioration de la précision de l’imagerie vasculaire et du traitement du cancer.
2. Quelles difficultés techniques avez-vous rencontrées lors de l’imagerie dans le domaine du NIR ? Comment ont-elles été résolues ?
Pour démontrer la capacité de ciblage des nanoparticules BTB-RGD, nous avons d’abord dû déterminer leur capacité de ciblage sur les cellules tumorales par des essais cellulaires. Pour ce faire, il a fallu utiliser la microscopie confocale. Toutefois, la plupart des microscopes confocaux classiques sont équipés de lasers limités au domaine du visible. Ainsi, pour valider l’efficacité de la sonde de ciblage NIR-II, nous n’avons pu démontrer qu’indirectement la capacité de ciblage de cette sonde en la remplaçant par une structure similaire dans le domaine du visible. Cependant, cette approche ne peut pas démontrer visuellement la capacité de ciblage de la sonde NIR-II elle-même. Elle augmente également la tâche de préparation de la sonde pendant l’expérience.
L’utilisation d’un microscope confocal équipé d’un laser NIR est donc particulièrement importante. Pour résoudre le problème, nous avons utilisé un microscope confocal à balayage laser FLUOVIEW ™ FV3000 mis à niveau avec la solution d’imagerie proche infrarouge (NIR) FV3000 Red. À l’aide du système FV3000 Red, nous avons pu déterminer la capacité de ciblage des nanoparticules BTB-RGD sur les cellules tumorales. La figure 3 montre qu’après incubation avec 40 μg/mL-1 de nanoparticules BTB-RGD seules, le signal de fluorescence des cellules cancéreuses était considérablement plus élevé que celui du groupe témoin incubé avec des nanoparticules BTB. En revanche, l’intensité de la fluorescence des cellules 3T3 normales incubées avec les nanoparticules BTB-RGD ne différait pas significativement de celle des cellules ayant reçu un traitement par nanoparticules BTB. Ces résultats suggèrent que les nanoparticules, après fonctionnalisation avec le peptide RGD, peuvent cibler spécifiquement les cellules tumorales surexprimant l’intégrine αvβ3.
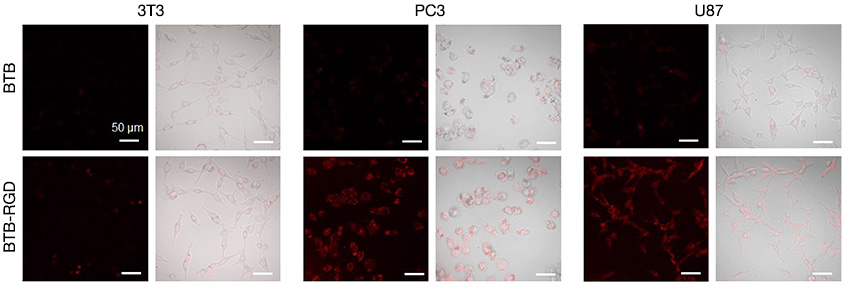
Figure 3. Images confocales de cellules 3T3, PC3 et U87 après incubation avec 40 μg/mL-1 de nanoparticules BTB-RGD ou BTB pendant 4 heures.
Longueur d’onde d’excitation : 730 nm, filtre : 760-890 nm, échelle graphique = 50 μm.
Dans les expériences précédentes, le marquage tumoral ne pouvait être confirmé qu’indirectement. On le confirmait en remplaçant la sonde par une structure similaire dans le spectre visible, car la plage d’observation du système était limitée à la lumière visible uniquement. En utilisant le système FV3000 Red dans cette expérience, nous avons pu mesurer le marquage par les nanoparticules BTB-RGD des cellules tumorales sans devoir remplacer la sonde.
Solutions de proche infrarouge (NIR) pour la microscopie confocale
Le système FV3000 Red étend les capacités de détection des longueurs d’onde du microscope FV3000 au domaine du NIR. Chacun de ses modules d’imagerie ayant été optimisé pour permettre la détection des longueurs d’onde dans le NIR, notamment le laser, les composants optiques, l’objectif et le détecteur, le système FV3000 Red fournit une solution spécialisée offrant une imagerie NIR multicolore plus sensible et précise.
Caractéristiques du système FV3000 Red :
|
| Mention spécialeCette note d’application a été rédigée avec l’aide du chercheur suivant : Dr Kai Li, Southern University of Science and Technology |
Bibliographie : 1. YAO, V. J., D’ANGELO, S., BUTLER, K. S., THERON, C., SMITH, T. L., MARCHIO, S., GELOVANI, J. G., SIDMAN, R. L., DOBRAFF, A. S., BRINKER, C. J., BRADBUTY, A. R. M., ARAP., W., et PASQUALINI, R. « Ligand-targeted theranostic nanomedicines against cancer », Journal of Controlled Release, vol. 240, 2016, p. 267-286. 2. GUO, B., SHENG, Z., HU, D., LIU, C., ZHENG, H., et LIU, B. « Through Scalp and Skull NIR-II Photothermal Therapy of Deep Orthotopic Brain Tumors with Precise Photoacoustic Imaging Guidance », Advanced Materials, vol. 30, 2018, 1802591. 3. BAGNATO, G. L., IRRERA, N., PIZZINO, G., SANTORO, D., ROBERTS, W. N., BAGNATO, G., PALLIO, G., VACCARO, M., SQUADRITO, F., SAITTA, A., ALTAVILLA, D., et BITTO, A. « Dual αvβ3 and αvβ5 blockade attenuates fibrotic and vascular alterations in a murine model of systemic sclerosis », Clinical Science, vol. 132m 2018, p. 231-242. 4. ZOPPI, N., CHIARELLI, N., CINQUINA, V., RITELLI, M., et COLOMBI, M. « GLUT10 deficiency leads to oxidative stress and non-canonical αvβ3 integrin-mediated TGFβ signalling associated with extracellular matrix disarray in arterial tortuosity syndrome skin fibroblasts », Human Molecular Genetics, vol. 24, 2015, p. 6769-6787. 5. LI, Y., LI, Z., HU, D., WANG, S., ZHA, M., LU, S.-B., SHENG, Z., et LI, K. « Targeted NIR-II emissive nanoprobes for tumor detection in mice and rabbits », Chemical Communications, vol. 57, 2021, p. 6420-6423.
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.

