Verificação de marcação tumoral de uma nova nanossonda fluorescente usando formação de imagem com NIR
Graças a suas vantagens de alta resolução espacial e temporal, alta sensibilidade de detecção, tempo curto de resposta e boa operabilidade, a técnica de imagens de fluorescência (Fluorescence imaging, FLI) é amplamente usada em diversos processos biomédicos de formação de imagem em contextos pré-clínicos e clínicos. A aplicação de capacidades de infravermelho próximo (Near-infrared, NIR) às imagens de fluorescência agrega suas próprias vantagens de observação profunda, baixa fototoxicidade e pouca interferência com a autofluorescência do tecido. Como resultado, as imagens de fluorescência com NIR passaram a ser uma técnica popular na área de pesquisa médica, especialmente no tratamento de tumores.
Imagens de fluorescência na região NIR-II
Comparadas aos tradicionais marcadores fluorescentes, como proteínas e corantes fluorescentes, as nanossondas fluorescentes podem alcançar facilmente a formação de imagens usando excitação por NIR mediante ajuste da composição química e tamanho morfológico. Além disso, é possível modificar as nanossondas fluorescentes adicionalmente para localização, distribuição de fármacos e detecção multimodal.
Até hoje, os pesquisadores já exploraram várias sondas fluorescentes para satisfazer a crescente demanda por oportunidades na área de diagnóstico e tratamento de alta precisão. Apesar disso, a maioria das sondas fluorescentes convencionais produz emissões na região visível ou NIR-I (400 a 1.000 nm). Isso acaba limitando bastante as aplicações na formação de imagens na área biomédica, devido a perdas como baixa profundidade de penetração no tecido e baixa resolução espacial.
Conforme apresentado em estudos recentes, as imagens de fluorescência foram ampliadas para a região NIR-II (1.000 a 1.700 nm). Devido a suas propriedades de formação de imagens com baixa dispersão de luz e baixa autofluorescência, a técnica apresenta grande potencial para a observação profunda de tecido, como alta sensibilidade e clareza. Como resultado, esse método é capaz de fornecer informações cruciais in vivo que não seriam facilmente reveladas usando técnicas convencionais de imagens de fluorescência.
Embora a tecnologia de imagens de fluorescência continue avançando, é difícil adaptar perfeitamente métodos individuais de formação de imagem óptica de modalidade única aos requisitos atuais da detecção in vivo, profunda, ultrassensível, 3D e de alta resolução espacial e temporal. Como resultado, há uma necessidade urgente para o desenvolvimento de sistemas multimodais de detecção óptica.
Combinação de métodos de imagens biológicas para melhorar a exatidão da formação de imagem
A imagem fotoacústica (Photoacoustic imaging, PAI) é um método biomédico não destrutivo de formação de imagem que vem sendo desenvolvido nos últimos anos. Quando um laser pulsado é irradiado em tecidos biológicos, o sinal de ultrassom gerado pelos tecidos biológicos carrega informações sobre as características de absorção de luz dos tecidos. Consequentemente, a formação de imagem com duas modalidades, combinando FLI com NIR-II e PAI com NIR-I, aproveita as vantagens de cada técnica enquanto promove compensações mútuas e pode melhorar efetivamente a exatidão da formação de imagem. Essa utilização combinada também tem grande potencial de aplicação para diagnósticos eficientes.
O traçado da sonda é particularmente importante para garantir uma formação de imagem de alta qualidade. Moléculas com estruturas do tipo doador-aceitador-doador (D-A-D) vêm atraindo bastante atenção para o design molecular com NIR-II graças aos excelentes níveis de biocompatibilidade, estruturas químicas bem definidas e propriedades ópticas personalizáveis. A fim de obter emissão de NIR-II, a unidade com grande deficiência de elétrons, benzo[1,2-c:4,5-c']bis([1,2,5]tiadiazol (BBTD) é usada mais amplamente como aceitador (Figura 1a).
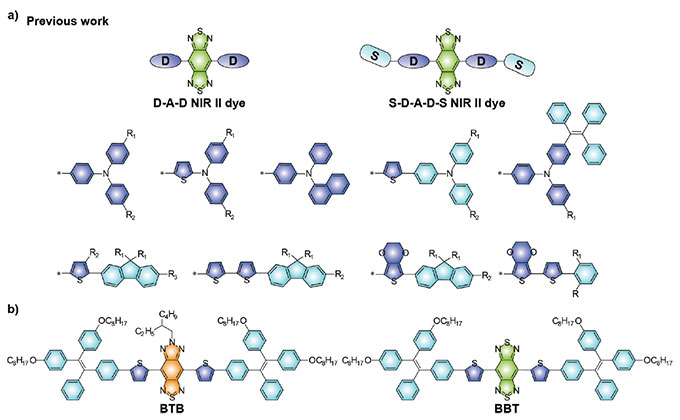
Figura 1. (a) Moléculas fluorescentes por NIR-II representativas do tipo D-A-D com base em receptores BBTD. (b) Estruturas químicas da molécula fluorescente BTB por NIR-II e a molécula fluorescente BBT de controle relatada no artigo.
Os rendimentos quânticos (Quantum yields, QYs) de fluorescência de moléculas por NIR-II com uma estrutura D-A-D são relativamente baixos devido à presença de efeitos fortes de transferência intramolecular de carga (Intramolecular charge transfer, ICT). Várias estratégias foram desenvolvidas para melhorar os QYs. Essas estratégias incluem a ligação a corantes com estruturas hidrofóbicas de proteínas, a construção de fluoróforos com propriedades de emissão induzidas por agregação, a inserção de unidades de blindagem em estruturas moleculares e o desenvolvimento de moléculas antirruptura.
No entanto, os QYs da maioria das moléculas fluorescentes por NIR-II com estruturas D-A-D ainda são relativamente baixos devido a seus efeitos inerentes de ICT. Além disso, a BBTD precisa de condições sintéticas relativamente inóspitas. Isso limita o desenvolvimento de moléculas fluorescentes por NIR-II mais avançadas mediante funcionalização. Portanto, é importante explorar novas unidades receptoras a fim de fornecer mais estratégias alternativas de design para a aplicação abrangente de moléculas fluorescentes por NIR-II.
Requisitos técnicos da formação de imagem com sonda fluorescente por NIR
A detecção de sondas multimodais NIR in vitro/in vivo também apresenta novos desafios para os instrumentos de formação de imagem. Comparada à formação de imagem confocal convencional, a formação de imagem com sonda fluorescente por NIR precisa satisfazer os seguintes requisitos técnicos:
- A maioria dos microscópios confocais convencionais têm comprimentos de onda de excitação entre 400 e 650 nm. A formação de imagem por NIR requer lasers NIR com comprimentos de onda > 700 nm.
- Os componentes ópticos da formação de imagem convencional (p. ex., ressonador de rastreamento, lente objetiva e grade) estão quase que exclusivamente no intervalo visível para transmissão/calibração. Isso não é capaz de garantir a eficiência e a exatidão da formação de imagem por NIR.
- A detecção de NIR exige um detector dedicado para NIR > 750 nm. Os detectores comuns têm uma eficiência de detecção muito baixa na região de NIR.
Nova nanossonda fluorescente para imagens fotoacústicas e de fluorescência por NIR-II
Juntos, o grupo do Dr. Li Kai na SUSTech, o grupo do Dr. Liu Jie na Universidade de Tecnologia de Nanjing e o grupo do Dr. Chen Hao no Instituto de Ciências Farmacêuticas de Xangai, Academia Chinesa de Ciências, propuseram uma estratégia de design molecular de engenharia de receptor visando obter sondas fluorescentes por NIR-II com altos coeficientes de absorbância e rendimentos quânticos (Figura 1b). Essa estratégia viabilizou sondas funcionalizadas para a detecção direcionada de tumores em condições bidimensionais e tridimensionais.
Os resultados do estudo foram publicados on-line em 10 de novembro de 2021 em um artigo intitulado “Receptor Engineering of Small Molecule Fluorophores for NIR-II Fluorescent and Photoacoustic Imaging” (Engenharia de receptor de fluoróforos de pequenas moléculas para imagens fotoacústicas e de fluorescência por NIR-II, em tradução livre) no Journal of Materials Chemistry B.
Conversamos com o Dr. Yaxi Li, um dos primeiros autores do artigo, para saber mais sobre os principais achados e a experiência geral da pesquisa:
1. Quais são as vantagens da nova nanossonda fluorescente na área de imagens biológicas?
As sondas fluorescentes convencionais não são direcionadas ao tumor. Muitas vezes, elas ficam retidas nos tumores devido ao aumento do efeito de permeabilidade e retenção (efeito EPR), tornando-as úteis para a formação de imagem de tumores in vivo. No entanto, essa abordagem de enriquecimento passivo exige um determinado tamanho de nanopartículas e costuma ser ineficiente. Portanto, para aumentar o enriquecimento de sondas fluorescentes em sítios tumorais e aprimorar o efeito de formação de imagem para um diagnóstico in vivo altamente exato, modificamos a superfície da nanossonda com o peptídeo direcionador Arg-Gli-Asp (RGD) a fim de obter nanossondas BTB-RGD.
Conforme ilustrado na Figura 2a, o camundongo que recebeu a injeção de nanossondas BTB-RGD intravenosa por 48 horas apresentou um aumento significativo no sinal de fluorescência por NIR-II no sítio tumoral, com o sinal atingindo o valor máximo em 48 horas. Para fins de comparação, um camundongo controle que recebeu nanossondas BTB sem capacidade de direcionamento apresentou apenas um aumento fraco no sinal de fluorescência no sítio tumoral. Uma análise quantitativa (Figura 2b) mostrou que os sinais de sítio tumoral de um camundongo tratado com nanossondas BTB-RGD sempre foram maiores que os sinais do grupo controle.
Além das imagens de fluorescência, empregamos uma tomografia fotoacústica (Photoacoustic tomography, PAT) para confirmar adicionalmente o efeito geral de direcionamento de nanossondas BTB-RGD em sítios tumorais (Figura 2c). A intensidade do sinal fotoacústico nos sítios tumorais de camundongos que receberam as injeções de nanossondas BTB-RGD também foi maior em relação ao camundongo tratado com o controle. Isso é algo consistente com os resultados de imagens de fluorescência por NIR-II.
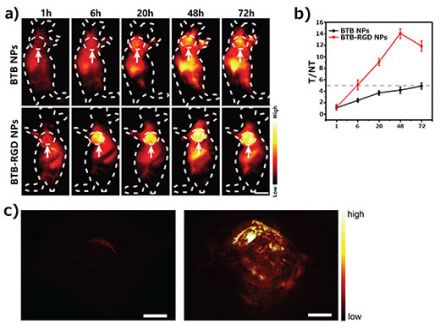
Figura 2. (a) Imagens representativas de imagem de fluorescência por NIR-II de camundongos portadores de tumor 143B obtidas 72 horas após a injeção de nanossondas BTB-RGD ou nanossondas BTB sob a excitação de um laser de 808 nm (140 mW/cm-2); filtro: 1.000 nm passa-banda longa. As setas indicam os tumores subcutâneos. Número de camundongos por grupo (n) = 4. Barra de escala = 5 mm. (b) Proporção T/NT do tumor 143B rastreado por 72 horas. Os dados estão representados graficamente como média ± DP, n = 4. (c) Imagens fotoacústicas tridimensionais de tumores 143B (excitação de 730 nm) em camundongos 48 horas após a injeção de nanossondas BTB (esquerda) ou BTB-RGD (direita). Barra de escala = 2 mm.
Esses resultados de formação de imagem demonstram com êxito o altíssimo potencial das sondas fluorescentes que desenvolvemos para aplicações de imagens biológicas em modo duplo. Por um lado, a alta sensibilidade das imagens de fluorescência por NIR-II foi usada com sucesso para alcançar uma formação nítida de imagem bidimensional das margens tumorais. Por outro lado, em comparação com as imagens de fluorescência, a PAT tem resolução e sensibilidade temporais relativamente menores, mas é capaz de fornecer resolução espacial superior e visualização 3D.
Essa abordagem de formação de imagem dupla vai facilitar a reconstrução de imagens volumétricas de tecidos tumorais, uma capacidade altamente valiosa para aplicações clínicas translacionais. Por exemplo, os médicos podem avaliar as informações de volume 3D do tecido tumoral e realizar formação de imagem fluoroscópica para remoção cirúrgica de tumor com apenas uma dose de contraste. Portanto, a integração dessas duas modalidades de formação de imagem usando um só agente de contraste oferece oportunidades incríveis para uma formação precisa de imagem vascular e para o tratamento de câncer.
2. Quais dificuldades técnicas vocês encontraram com a formação de imagens na região de NIR? Como elas foram superadas?
Para demonstrar a capacidade de direcionamento de nanossondas BTB-RGD, primeiramente precisávamos determinar essa capacidade em células tumorais por meio de ensaios celulares. Isso exigiu o uso de microscopia confocal. No entanto, a maioria dos microscópios confocais convencionais estão equipados com lasers limitados à região visível. Logo, para validar a sonda de direcionamento por NIR-II, o grupo só poderia demonstrar indiretamente a capacidade de direcionamento mediante a substituição da sonda por uma estrutura semelhante na região visível. No entanto, essa abordagem não é capaz de demonstrar visualmente a capacidade de direcionamento da própria sonda por NIR-II. Ela também aumenta a carga de trabalho na preparação da sonda durante o experimento.
Portanto, ter um microscópio confocal equipado com um laser NIR é algo particularmente importante. Visando solucionar essa dificuldade, usamos um microscópio confocal de varredura a laser FLUOVIEW™ FV3000 equipado com a solução FV3000 Red de formação de imagem por infravermelho próximo (Near-infrared, NIR). Com o sistema FV3000 Red, obtivemos êxito na determinação da capacidade de direcionamento de nanossondas BTB-RGD em células tumorais. A Figura 3 mostra que após a incubação exclusiva com 40 μg mL-1 de nanossondas BTB-RGD, o sinal de fluorescência de células cancerosas foi significativamente superior em relação ao grupo controle de nanossondas BTB. Por outro lado, a intensidade de fluorescência de células 3T3 normais incubadas com nanossondas BTB-RGD não diferiu significativamente em relação ao tratamento com nanossondas BTB. Esses resultados sugerem que após a funcionalização com RGD, as nanopartículas podem promover o direcionamento específico de células tumorais com expressão excessiva da integrina αvβ3.
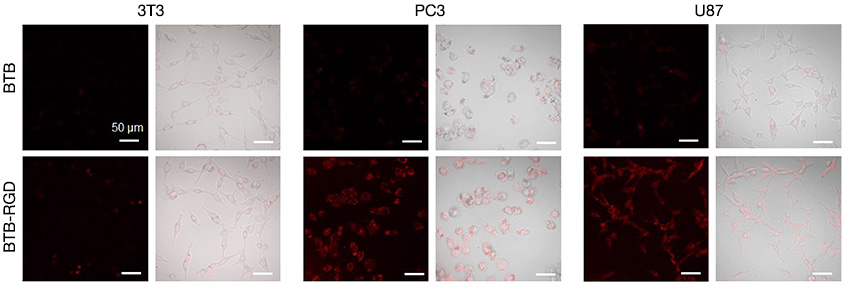
Figura 3. Imagens confocais de células 3T3, PC3 e U87 após 4 horas de incubação com 40 μg mL-1 de nanossondas BTB-RGD ou BTB. Comprimento de onda de excitação: 730 nm, filtro: 760 a 890 nm, barra de escala = 50 μm.
Em experimentos anteriores, só foi possível confirmar a marcação tumoral de maneira indireta. Isso foi feito mediante a substituição da sonda por uma estrutura semelhante no intervalo visível, já que o intervalo de observação do sistema estava limitado apenas à luz visível. Ao empregar o sistema FV3000 Red nesse experimento, conseguimos medir com êxito a marcação de nanossondas BTB-RGD em células tumorais sem a substituição da sonda.
Soluções de infravermelho próximo (NIR) para microscopia confocal
O sistema FV3000 Red amplia as capacidades de detecção de comprimento de onda do microscópio FV3000 para a região de NIR. Ao atualizar cada módulo de formação de imagem para detecção por NIR, incluindo o laser, o conjunto óptico, a lente objetiva e o detector, o sistema FV3000 Red oferece uma solução especializada para uma formação de imagem multicores mais sensível e exata por NIR.
Características do FV3000 Red:
|
| AgradecimentosEsta nota de aplicação foi preparada com a ajuda do seguinte pesquisador: Dr. Kai Li, Universidade de Ciências e Tecnologia do Sul |
Referências: 1.V. J. Yao, S. D’Angelo, K. S. Butler, C. Theron, T. L. Smith, S. Marchio, J. G. Gelovani, R. L. Sidman, A. S. Dobraff, C. J. Brinker, A. R. M. Bradbuty, W. Arap. and R. Pasqualini, Ligandtargeted theranostic nanomedicines against cancer, J. Control. Release 2016, 240, 267-286. 2. B. Guo, Z. Sheng, D. Hu, C. Liu, H. Zheng, B. Liu, Through Scalp and Skull NIR-II Photothermal Therapy of Deep Orthotopic Brain Tumors with Precise Photoacoustic Imaging Guidance, Adv. Mater. 2018, 30, 1802591. 3. G. L. Bagnato, N. Irrera, G. Pizzino, D. Santoro, W. N. Roberts, G. Bagnato, G. Pallio, M. Vaccaro, F. Squadrito, A. Saitta, D. Altavilla, and A. Bitto, Dual αvβ3 and αvβ5 blockade attenuates fibrotic and vascular alterations in a murine model of systemic sclerosis, Clin. Sci. 2018, 132, 231-242. 4. N. Zoppi, N. Chiarelli, V. Cinquina, M. Ritelli, and M. Colombi, GLUT10 deficiency leads to oxidative stress and non-canonical αvβ3 integrin-mediated TGFβ signalling associated with extracellular matrix disarray in arterial tortuosity syndrome skin fibroblasts, Hum. Mol. Genet. 2015, 24, 6769-6787. 5. Y. Li, Z. Li, D. Hu, S. Wang, M. Zha, S.-B. Lu, Z. Sheng, and K. Li, Targeted NIR-II emissive nanoprobes for tumor detection in mice and rabbits, Chem. Commun. 2021, 57, 6420-6423.
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.

