Procesamiento de imágenes de intervalo de tiempo en 3D de esferoides con el microscopio confocal FLUOVIEW FV3000: Observación continuada durante 48 horas de la citotoxicidad mediada por células dependientes de anticuerpos (ADCC)
La citotoxicidad mediada por células dependientes de anticuerpos (ADCC) es uno de los mecanismos de acción de los fármacos anticuerpos. Las células efectoras, como los monocitos y las células aniquilantes naturales (NK) reconocen las células objetivo (como las células cancerígenas) que están vinculadas a un anticuerpo. Después de reconocer el anticuerpo, las células efectoras destruyen las células objetivo liberando factores citotóxicos que inducen la lisis celular. En esta aplicación, hemos realizado un experimento de cocultivo en tres dimensiones usando células de cáncer de colon humano (HT-29) y células NK (KHYG-1) que expresan un receptor funcional de Fcgamma (FCγ) en presencia de anticuerpos monoclonales terapéuticos humanos específicos de EGFR, y los observamos durante 48 horas usando el microscopio confocal FLUOVIEW FV3000. La imagen resultante en tres dimensiones (3D) de ADCC nos permitió capturar la forma en que las células NK atacan a las células cancerígenas.
Procesamiento de imágenes esferoides de células vivas en 3D con fototoxicidad reducida
Las masas celulares cultivadas en un sistema de cultivos en 3D (denominadas esferoides) son difíciles de procesar debido al espesor de la masa. Para producir una señal fluorescente fuerte que pueda detectarse suele necesitarse una intensidad alta de la luz de excitación. Sin embargo, la luz de excitación más alta también aumenta la fototoxicidad y provoca daños a las células. Para evitarlo, se usó el microscopio FV3000, que incorpora la tecnología de detección TruSpectral de Olympus, a fin de capturar las señales fluorescentes débiles y minimizar la potencia láser necesaria para generar la señal en profundidad dentro del esferoide. Además, usamos el objetivo de inmersión en aceite de silicona 60X (coincidiendo con el índice de refracción de las células vivas) con el fin de conseguir imágenes más brillantes con una resolución superior para una observación profunda. Combinando estas dos tecnologías, hemos capturado con éxito brillantes imágenes 3D en intervalos de tiempo de un esferoide durante 48 horas, a medida que colapsaba debido a la muerte celular HT-29 mediada por la célula NK.
Videos asociados |
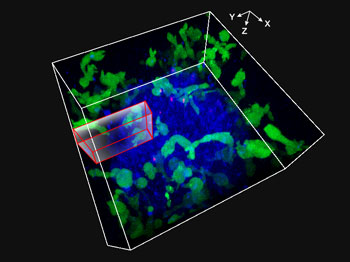
Fig. 1: Video obtenido mediante procesamiento de imágenes en 3D de células NK atacando células tumorales HT-29 esferoides durante 48 horas
La línea celular NK de KHYG-1 (verde) expresando receptores funcionales Fcgamma (FCγ) y las proteínas fluorescentes ZsGreen se cultivaron con esferoides de células HT-29 (líneas celulares derivadas de cáncer colorrectal). Las superficies de las células HT-29 se marcaron con cetuximab de anticuerpo monoclonal anti-EGFR (Alexa Fluor 647, azul). Las células NK y HT-29 se cultivaron en presencia de bromodesoxiuridina (BrdU) y el procesamiento de imágenes XYZT se realizó durante 48 horas. El núcleo marcado en rojo (marcando la absorción celular de PI) se utilizó como indicador de muerte celular.
Condiciones de procesamiento de imágenes
Objetivo: objetivo de inmersión en aceite de silicona 60X (UPLSAPO60XS)
Microscopio: sistema FLUOVIEW FV3000
Láser: 488 nm (ZsGreen, verde), 561 nm (PI, rojo), 640 nm (Alexa Fluor 647, azul)
El sistema de compensación de desplazamiento en Z permite procesar imágenes precisas de intervalo de tiempo
Para experimentos que evalúan la eficacia de los fármacos anticuerpos, es indispensable poder procesar imágenes de células vivas a largo plazo. Para capturar con mayor precisión el efecto de las células NK en las células cancerígenas esferoides, usamos un compensador de desplazamiento en Z (IX3-ZDC2) para impedir que se produjesen cambios en el enfoque a causa de los cambios medioambientales externos como las variaciones de temperatura. El IX3-ZDC2 permitió obtener una imagen de intervalo de tiempo en un periodo prolongado sin perder enfoque en el esferoide. Esto permitió confirmar que las células NK cambian activamente su forma a medida que atacan y penetran en la masa tumoral.
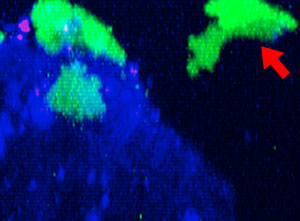 9h | 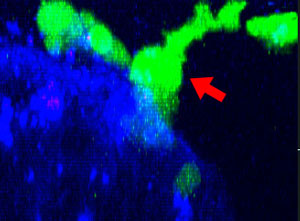 11h | 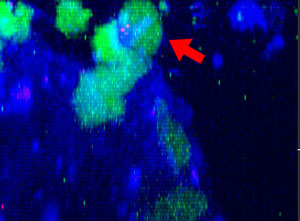 17h | 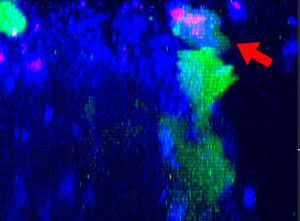 22h | 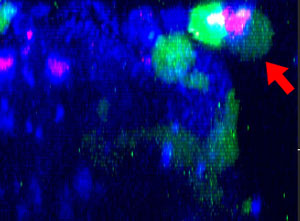 24h |
Fig. 2: KHYG-1 de línea celular NK (verde) cambiando de forma mientras ataca y aniquila células tumorales HT-29 etiquetadas con cetuximab (azul). La absorción de PI (rojo) indica la muerte celular.
¿Cómo el microscopio confocal FV3000 favoreció a nuestro experimento?
Sistema completamente espectral que proporciona una alta sensibilidad
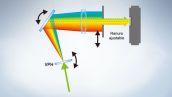
La serie FV3000 emplea la tecnología TruSpectral de Olympus que difracta la luz por medio de la emisión a través de la unidad de holograma de fase de volumen. Esta tecnología proporciona una emisión de luz mucho mayor que la de las unidades de detección espectral convencionales con rejillas de tipo reflexión, y minimiza la potencia láser necesaria para llevar una observación de tejido profundo.
Mantenimiento de enfoque con el sistema de compensación de desplazamiento en Z (ZDC)
El compensador de desplazamiento en Z (o Z-drift) IX3-ZDC2 usa luz infrarroja de mínima fototoxicidad (clase de láser 1) para identificar la ubicación del plano de la muestra. El modo autoenfoque (AF) en una sola toma otorga varias posiciones de enfoque para configurarlas según lo requerido para muestras profundas, lo que permite adquisiciones en pila de Z en experimentos de múltiples posiciones.
Videos asociados |
Objetivos de inmersión en silicona para una observación en profundidad con alta resolución de imágenes de células vivas
El índice de refracción del aceite de silicona (ne≈1,40) es muy similar al del tejido vivo (ne≈1,38), lo que permite realizar observaciones de alta resolución en profundidad dentro del tejido vivo, minimizando la aberración esférica debida a las diferencias entre los índices de refracción. El aceite de silicona no se seca ni se endurece, por lo que no es necesario volver a rellenarlo. Esto lo hace ideal para observaciones de intervalo de tiempo prolongado.
Videos asociados |
Comentario del Dr. Yuji Mishima
Dr. Yuji Mishima | En los últimos años, la demanda de imágenes por fluorescencia en el estudio del cáncer ha aumentado, al igual que el número de experimentos necesarios para evaluar estéricamente la eficacia de los fármacos anticuerpos, especialmente con células esferoides. Los esferoides son muy difíciles de observar usando fluorescencia debido a su grosor; pero la utilización del microscopio FV3000 permitió observar las células cancerígenas esferoides en su totalidad durante 48 horas. Durante el experimento ADCC, pudimos medir de forma precisa las células cancerígenas vivas, las células muestras y las células efectoras (células NK) a medida que respondían al tratamiento con anticuerpos. Noté que el microscopio FV3000 era muy efectivo para evaluar la eficacia terapéutica del fármaco anticuerpo. |
Reconocimientos
Esta nota de aplicación ha sido preparada con la ayuda de los siguientes investigadores.
The Cancer Chemotherapy Center of JFCR, Dr. Yuji Mishima
Productos usados para esta aplicación
se ha añadido correctamente a sus marcadores
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
