Imagerie 3D de sphéroïdes par intervalles de temps réguliers avec le microscope confocal FLUOVIEW FV3000 : observation continue pendant 48 heures de la cytotoxicité cellulaire dépendante des anticorps (ADCC)
La cytotoxicité cellulaire dépendante des anticorps (ADCC) est l’un des mécanismes d’action des anticorps thérapeutiques. Les cellules effectrices, telles que les cellules tueuses naturelles (NK) et les monocytes, reconnaissent les cellules cibles (telles que les cellules cancéreuses) auxquelles un anticorps s’est lié. Lorsqu’elles reconnaissent l’anticorps, les cellules effectrices détruisent les cellules cibles en libérant des facteurs cytotoxiques qui provoquent une lyse cellulaire. Dans cette application, nous avons réalisé une expérience de co-culture tridimensionnelle en utilisant des cellules de cancer du côlon humain (HT-29) et des cellules NK (KHYG-1) exprimant un récepteur Fcgamma (FCγ) fonctionnel en présence d’anticorps monoclonaux thérapeutiques ciblant l’EGFR humain, et nous les avons observées pendant quarante-huit heures à l’aide du microscope confocal FLUOVIEW FV3000. L’imagerie tridimensionnelle (3D) de l’ADCC ainsi obtenue nous a permis de filmer la manière dont les cellules NK attaquent les cellules cancéreuses.
Imagerie 3D des sphéroïdes de cellules vivantes avec une phototoxicité réduite
Les images des masses cellulaires se développant dans un système de culture 3D (que l’on appelle des sphéroïdes) sont difficiles à capturer en raison de l’épaisseur de la masse. Une intensité plus importante de la lumière d’excitation est généralement requise afin de produire un signal fluorescent suffisamment puissant pour être détecté. Cependant, une lumière d’excitation plus puissante entraîne également une augmentation de la phototoxicité, ce qui endommage les cellules. Pour résoudre ce problème, nous avons utilisé le microscope FV3000, qui intègre la technologie de détection TruSpectral d’Olympus, afin de capturer les signaux fluorescents faibles et minimiser la puissance laser requise pour la génération d’un signal en profondeur dans un sphéroïde. De plus, nous avons utilisé un objectif à immersion dans l’huile de silicone X60 (avec un indice de réfraction proche de l’indice de réfraction des cellules vivantes) afin d’obtenir des images plus lumineuses avec une résolution plus élevée pour l’observation en profondeur. En associant ces deux technologies, nous avons pu capturer, à intervalles de temps réguliers pendant 48 heures, des images 3D lumineuses d’un sphéroïde tout au long de sa désintégration causée par la mort des cellules HT-29 induite par les cellules NK.
Related Videos |
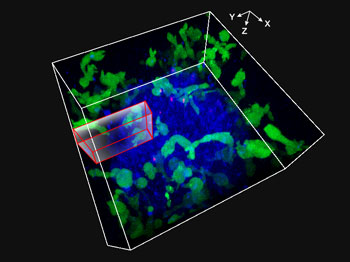
Fig. 1 : Film obtenu par imagerie 3D des cellules NK attaquant un sphéroïde de cellules tumorales HT-29 pendant 48 heures
Des cellules NK de la lignée KHYG-1 (vert) exprimant des récepteurs Fcgamma (FCγ) fonctionnels et des protéines fluorescentes ZsGreen ont été cultivées avec des sphéroïdes de cellules HT-29 (lignées cellulaires dérivées du cancer colorectal). Les surfaces des cellules HT-29 ont été marquées avec du cétumixab, un anticorps monoclonal dirigé contre l’EGFR (Alexa Fluor 647, bleu). Les cellules HT-29 et NK ont été cultivées en présence d’iodure de propidium (IP), et une imagerie XYZT a été effectuée tout au long d’une période de 48 heures. Le marquage des noyaux en rouge (signalant l’absorption cellulaire de l’IP) a été utilisé pour indiquer la mort cellulaire.
Conditions d’imagerie
Objectif : objectif à immersion dans l’huile de silicone X60 (UPLSAPO60XS)
Microscope : système FLUOVIEW FV3000
Lasers : 488 nm (ZxGreen, vert), 561 nm (IP, rouge), 640 nm (Alexa Fluor 647, bleu)
Une imagerie à intervalles de temps réguliers précise grâce au système de compensation de la dérive du Z
Pour les expériences qui évaluent l’efficacité d’anticorps thérapeutiques, l’imagerie à long terme des cellules vivantes est indispensable. Pour identifier plus précisément l’effet des cellules NK sur les cellules cancéreuses sphéroïdales, nous avons utilisé un compensateur de dérive du Z (IX3-ZDC2) afin d’empêcher toute modification de la mise au point causée par des changements de l’environnement, tels que les variations de température. Le système IX3-ZDC2 nous a permis d’obtenir une image par intervalles de temps réguliers sur une période prolongée sans perdre la mise au point sur le sphéroïde. Ainsi, nous avons pu confirmer que les cellules NK changent activement de forme pour attaquer et pénétrer dans la masse tumorale.
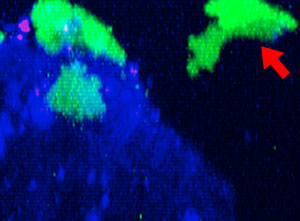 9h | 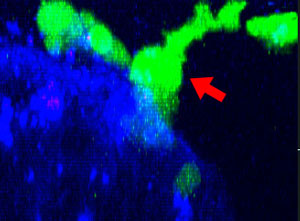 11h | 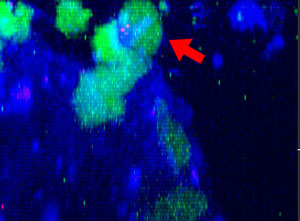 17h | 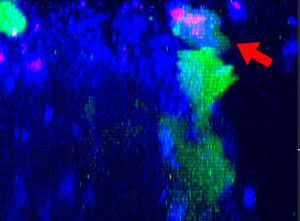 22h | 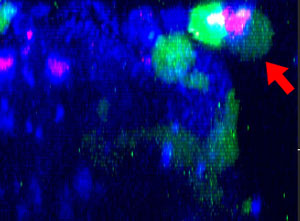 24h |
Fig. 2 : Cellules NK de la lignée KHYG-1 (vert) changeant de forme pour attaquer et tuer les cellules tumorales HT-29 marquées par le cétumixab (bleu). L’absorption d’IP (rouge) indique la mort cellulaire.
L’apport du microscope confocal FV3000 pour notre expérience
Le système intégralement spectral permet une sensibilité élevée
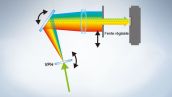
La gamme FV3000 repose sur la technologie de détection TruSpectral d’Olympus, qui diffracte la lumière en la transmettant à travers une unité holographique de phase volumique. Cette technologie permet d’obtenir une luminosité largement supérieure par rapport aux unités de détection spectrale conventionnelles équipées de réseaux de type à réflexion, tout en minimisant la puissance laser requise pour l’observation des tissus profonds.
Maintien de la mise au point avec le système de compensation de la dérive du Z (ZDC)
Le compensateur de dérive du Z IX3-ZDC2 utilise une lumière infrarouge à phototoxicité minimale (laser de classe 1) pour identifier la position du plan de l’échantillon. Le mode de mise au point automatique (AF) one-shot permet de définir plusieurs positions de mise au point selon les besoins pour les échantillons plus profonds, pour des acquisitions en focus stacking efficaces dans les expériences à positions multiples.
Related Videos |
Les objectifs à immersion dans du silicone pour l’imagerie de cellules vivantes assurent une observation haute résolution en profondeur
L’indice de réfraction de l’huile de silicone (n≈1,40) est proche de celui d’un tissu vivant (n≈1,38), ce qui permet d’effectuer des observations haute résolution en profondeur dans un tissu vivant avec une très faible aberration sphérique causée par la différence des indices de réfraction. De plus, l’huile de silicone ne sèche pas et ne durcit pas ; il n’est donc jamais nécessaire d’en rajouter. Elle est ainsi idéale pour les longues observations à intervalles de temps réguliers.
Related Videos |
Commentaire du Dr Yuji Mishima
Dr. Yuji Mishima | Ces dernières années, la demande en imagerie par fluorescence dans le domaine de la recherche contre le cancer a connu une grande augmentation, de même que le nombre d’expériences requises pour évaluer stériquement l’efficacité des anticorps thérapeutiques, en particulier avec les cellules sphéroïdes. Les sphéroïdes sont très difficiles à observer par fluorescence en raison de leur épaisseur, mais nous avons pu observer des cellules cancéreuses sphéroïdes dans leur totalité sur 48 heures grâce au microscope FV3000. Tout au long de l’expérience d’ADCC, nous avons pu mesurer précisément les cellules cancéreuses vivantes, les cellules mortes et les cellules effectrices (cellules NK) dans leur réponse au traitement par les anticorps. J’ai trouvé le FV3000 très utile pour évaluer l’efficacité des anticorps thérapeutiques. |
Remerciements
Cette note d’application a été rédigée avec l’aide des chercheurs suivants :
Dr Yuji Mishima, The Cancer Chemotherapy Center of JFCR
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
