スフェロイドにおける細胞内オートファジー経路の三次元解析
要約
薬剤の効能または毒性を予測するために3次元培養モデルが使用されてきました。このアプリケーションノートにおいて、我々は細胞内オートファジー経路に注目しています。最初に、モデルのオートファジーの状態を観察するためのEGFP-LC3プローブの有用性を確認しました。次に、FLUOVIEW共焦点顕微鏡FV3000とNoviSightソフトウェアを用いたオリンパスのTrue 3D解析ワークフローを使用して、クロロキンと呼ばれる薬剤候補の効果を定量的に評価しました。我々は、この解析ワークフローが生体内研究による薬剤候補のプロファイリングの代替策を提供することを実証しました。
序論
細胞内分子事象は、ヒトのさまざまな病状と密接に関係しています。オートファジーは、細胞のオルガネラとタンパク質を分解して再利用するという細胞内のプロセスであり、オートファジーの調節異常はヒトの疾患に関与しています。これらの疾患の過程をもっとよく理解し、それらに対する薬剤の効能を検証するためには、病的な状態や治療状態でのヒト細胞のオートファジーの状態を観察することが重要です。
スフェロイドやオルガノイドなどの3次元培養モデルは、複雑な生体内微小環境によく似ています。スフェロイド内の細胞に対する薬剤の効能を評価するには、細胞内顕微鏡画像を定量的に解析することが非常に重要です。このアプリケーションノートでは、オリンパスの共焦点顕微鏡FV3000と解析ソフトウェアNoviSightのTrue
3D解析ワークフローを使用して、動的な分子内オートファジー過程を評価し、薬剤候補の効果を定量的に評価しました。
利点
- 3次元培養モデル内での分子内事象の定量的解析
結果と考察
LC3タンパク質はオートファジー過程における有用なマーカーです。例えば、オートファゴソームが蓄積したときにEGFP-LC3蛍光のドットが増加することが報告されています。オートファジー活性やオートファゴソームのターンオーバーを調節する各種化合物によって、オートファゴソームの形成が調節されます。現在、これらの化合物のいくつかが臨床試験中です。その1つであるクロロキン(CQ)は、もともと抗マラリア薬でしたが、オートファゴソームとリソソームの融合を阻害することから、がん治療のための臨床試験が行われています。
2次元培養システムを用いたオートファジーマーカーの検証
我々は、2次元培養システムにおけるオートファジー過程に対するCQの阻害効果を測定するためのEGFP-LC3プローブの有用性を検証しました。EGFP-LC3を安定発現するU2OS骨肉腫細胞株を作製しました。マイクロプレートのウェル内で単層として細胞を培養しました。CQの添加後に、細胞を固定してHoechst
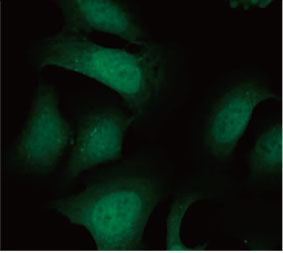
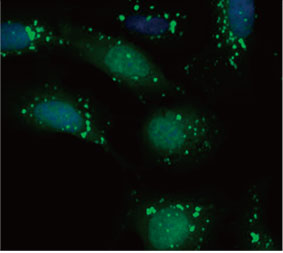
33342で染色しました。蛍光画像から、CQ処理によってEGFP-LC3の点状構造物の形成が引き起こされたことが分かりました(図1
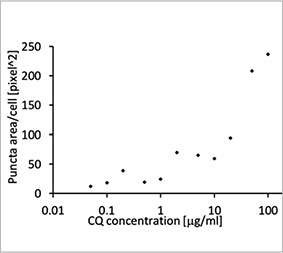
AおよびB)。各細胞の核の位置に基づいて、細胞1個当たりの点状構造物の面積を測定しました。CQ濃度が上がるにつれて点状構造物の面積が増大し、オートファジー過程の測定に、EGFP-LC3プローブが有用性であることが確認されました。
(A)
| (B)
| (C)
|
図1 Aおよび1 B:(A) 通常の条件下で培養されたEGFP-LC3発現U2OS細胞 (B) CQで1時間処理したEGFP-LC3発現U2OS細胞 図1 C:CQ濃度が上がるにつれて細胞1個当たりの点状構造物の面積が増大することを示すプロット | ||
がんスフェロイドモデルにおけるLC3点状構造物の定量化
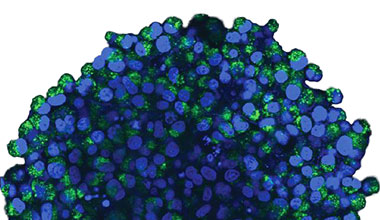
3次元培養モデルにおけるオートファジーの状態を観察するために、子宮頸がんから樹立されたHeLa細胞株を選択しました。HeLa細胞はスキャフォールドフリー3次元培養プロトコルに適しており、均等なサイズのがんスフェロイドを形成します。我々はEGFP-LC3を安定発現するHeLa細胞株を作製しました。
丸底低接着マイクロプレートに細胞を播種しました。5日間の培養後、スフェロイドをCQで7時間処理しました。続いて、スフェロイドを固定し、膜透過処理し、核染色を行い、最後にSCALEVIEW-S4(富士フイルム和光純薬)で透明化しました。
オリンパスのFLUOVIEW共焦点システムFV3000を使用して、スフェロイドを観察しました。使用したのはシリコーンオイル浸対物レンズ(UPLSAPO30XSIR)です。なぜなら、この対物レンズは開口数(NA)が高く、球面収差が小さいからです。図2
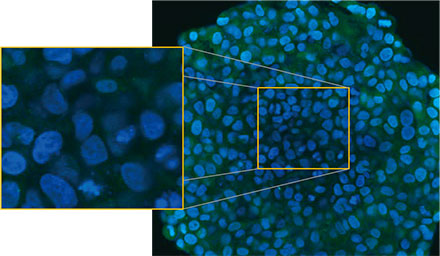
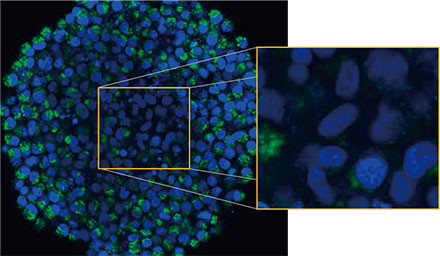
(A)※に、処理を施していないスフェロイドの赤道における1枚のZ断面画像を示します。EGFPシグナルが細胞内に均等に見られました。一方、CQ処理を施した場合は、細胞内における点状のEGFPシグナルの形成が誘発されました(図2
(B)※)。スフェロイドの周辺部と中心部の両方において、点状構造物の形成が認められました。CQ処理ではスフェロイドサイズの大きさに明らかな変化は見られなかったことから、細胞内オートファジー過程が3次元がんスフェロイドにおけるCQの効能を評価するためのより適切なマーカーであることが示唆されました。
3次元培養モデルにおける細胞内変化を定量的に解析するため、我々は、オリンパスのTrue 3D解析ワークフローを使用しました。これは共焦点顕微鏡FV3000を用いて取得した画像とNoviSightソフトウェアを用いた解析を組み合わせたものであり、従来の解析方法に比べて多くの利点があります。従来の解析では、複数枚のZ断面画像から認識された対象物の総合的な特性値を用いるか、複数枚のZ断面画像の投影像を解析していました。これらの方法では、目的のオブジェクトを複数回カウントしてしまったり、他のオブジェクトと重なって見えなくなってしまい、目的のオブジェクトが見落とされてしまう可能性があり、信頼性に欠けるという問題がありました。一方、オリンパスのTrue 3D解析ワークフローには、FLUOVIEWソフトウェアによって最適化されたZ間隔で連続的なZ断面画像を取得する機能が備わっています。ソフトウェアを用いて3次元ボリューム画像を再構築して、目的の対象物をボクセルの集まりとして認識しました。続いて、NoviSightソフトウェアを使用して統計的解析を行います。FLUOVIEWからNoviSightソフトウェアへのワークフローは複雑でないため、3次元培養モデルの解析に最適なプラットフォームとなります。
(A)
| (B)
|
図2 Aおよび2 B:(A) 通常の状態と(B)
CQ処理した場合のEGFP-LC3発現HeLa細胞スフェロイド。拡大画像は、スフェロイドの原画像の黄色い長方形の領域を示しています。※ | |
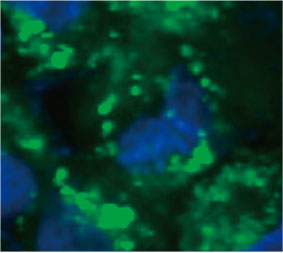
スフェロイド内のオートファジー陽性細胞の数を算出するため、ソフトウェアでは個々の細胞の核を識別しました。次に、個々の核を取り囲む領域をマスク領域として定義しました。最後に、マスク領域におけるEGFPシグナルの点状構造物が目的のオブジェクトとして認識されました(図2
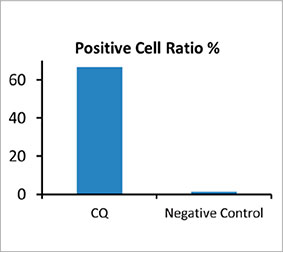
(C)※)。4個以上の点状構造物を持つ細胞がオートファジー陽性細胞とみなされました。薬剤処理を施していない3次元スフェロイドのオートファジー陽性細胞は約1.4%であったのに対し、CQ処理したスフェロイドのオートファジー陽性細胞は66.6%でした(図2
(D)※)。がんスフェロイド内でCQが点状構造物の形成を誘発したことが、定量解析でも裏付けられています。
(C)
|
| (D)
|
図2 Cの左:CQ処理したスフェロイド内の細胞の原画像 右:同じ画像で点状構造物が対象物(赤い長方形)として認識された状態※ | ||
結論
True 3D解析ワークフローの一部として、オリンパスのFLUOVIEW共焦点顕微鏡FV3000とNoviSightソフトウェアを使用して、3次元培養モデルにおける細胞内オートファジー過程に対するCQの効果を定量的に評価しました。本研究は、研究者がこのワークフローを利用して、用量依存的に薬効の有効性をプロファイリングしたり、複数の薬剤候補を客観的にスクリーニングしたりできることを示しています。他にも、染色体上のFISHシグナルや蛍光標識したシグナル伝達分子のトランスロケーションなど、薬剤の効能や毒性に関連した細胞内分子マーカーがあります。このワークフローは、3次元培養モデルにおける幅広い細胞内変化を定量的に評価するのに役立ち、in vivo試験の代わりとなる薬剤候補のプロファイリングを可能にします。
参考文献
- Maria C et al., (2019) Targeting autophagy to overcome human disease. International Journal of Molecular Sciences. 20(3): E725. doi: 10.3390/ijms20030725
- Yan C et al., (2013) Therapeutic targeting of autophagy in disease: Biology and Pharmacology. Pharmacological Reviews. 65: 1162–1197. doi: 10.1124/pr.112.007120
- Daniel JK et al., (2008) Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes. Autophagy. 4(2): 151–175. doi: 10.4161/auto.5338
著者
Kazuhito Goda
※HeLa細胞は医学研究で最も重要な細胞株の一つで、科学の発展に偉大な貢献をしました。しかし、この細胞の元となったヘンリエッタ・ラックス(Henrietta
Lacks)さんの同意が得られていなかった事実を認識しなければなりません。HeLa細胞の使用は、免疫学や、感染症学、癌研究などにおける重要な発見に貢献しましたが、同時に医学における個人情報保護や倫理についての重要な議論も引き起こしました。
ヘンリエッタ・ラックスさんの生涯と現代医学への貢献における詳細は、以下にアクセスしてご覧ください。
http://henriettalacksfoundation.org/
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。