ラボの閉鎖や休暇、突然発令される緊急事態宣言(!)などにより、研究から一時的に離れざるを得ないこともあるかと思います。事情はどうであれ、しばらく離れていたラボ作業に戻るのは骨の折れることかもしれません。 準備を整え、実験をセットし、目標を達成するにはどうすればよいでしょうか。
ラボへの復帰をスムーズするための手助けとして、実験を立ち上げ、開始するための4ステップガイドを作成しました。
1. 装置の電源を入れる
この問題は重要でないように思えますが、誤った方法で機器の電源を入れると、システム性能に悪影響を及ぼす恐れがあります。 いくつかの一般的なガイドラインを以下に示します。
- 最初にPCの電源を入れる:PCは顕微鏡システムの「頭脳」です。まず最初にPCの電源を入れてログオンすることを忘れないでください。
- システムのすべてのコンポーネントの電源を入れる:システム構成によって、構成品の電源を入れる順序が問題になることがあります。例えば、オリンパスのシステムでは、CBHの電源はTPC(タッチパネルコントローラー)よりも先に入れなければなりません。詳細はお手元のマニュアルをご覧ください。
- ソフトウェアを起動する:ソフトウェアの起動中にエラーが起こった場合は、以下の方法でいつでもお問い合わせください。技術サポートの要請は、お近くの販売代理店までお問い合わせいただくか、こちらからご連絡ください。
2. イメージングの準備をする
装置の電源が入ったら、イメージング用サンプルの準備、設置、水平化に時間をかけます。 役に立つヒントをいくつかご紹介します。
標本を準備する
まず、適切なカバーガラスを選択します。 カバーガラスは厚さ#1.5、つまり0.17mm(170µm)にします。 カバーガラスに合わせて設計されたオリンパスの対物レンズで良好な画質を得るには、カバーガラスを適切な厚さにする必要があります。 厚すぎたり薄すぎたりすると、光学アーチファクトが起こる可能性があります。
カバーガラスの厚さを確認し、標準的なガラス製スライドを使用してください。用途によっては、プラスチック製スライドも使用可能です。 ただし、蛍光イメージングではプラスチックの強力な自家蛍光が問題になります。 この場合、青および緑のチャンネルで強い背景光の原因となり、また、赤のチャンネルでも同じ現象が起こることがあります。
イメージング開始前にカバーガラスとスライドをクリーニングすることも重要です。適した洗浄液は、エタノール70%の蒸留水です。別の方法として、A.J. Funk and Co.のスパークル光学レンズクリーナーなどの光学クリーナーも使用できます。
光学系のクリーニングの際には、必ずレンズペーパーを使用してください。 ティッシュペーパーや研究室用ティッシュはざらざらしていて、光学系の表面を傷つける可能性があります。
標本を置く
次に、準備した標本を、顕微鏡に対して正しい向きに置きます。カバーガラスは、常に、正立顕微鏡の場合は表面を上に、倒立顕微鏡の場合は下に向けて置いてください。
倒立顕微鏡では、標本が良好に密封されていることを確認することが重要です。標本がしっかり密封されていないと、液体が対物レンズやレボルバーに接触する場合があります。 顕微鏡のハードウェアや電子機器の光学コーティングや光学接着剤、その他の部品にこの液がかかると、腐食や酸化を引き起こすおそれがあります。
標本を置く際は、対物レンズの作動距離に特に注意を払ってください。 簡単に言うと、作動距離とは、標本に焦点を合わせるために、対物レンズをどれだけ近づける必要があるかを意味します。作動距離は、わずか100µmから数ミリまで幅があります。
ご使用の対物レンズの作動距離はご存じでしょうか?同梱の仕様書またはオンラインの対物レンズ製品ページでご確認ください。

図1:倒立顕微鏡では、スライドの表面を下にして置く必要があります。倒立顕微鏡にカバースリップを表面を上にして置いたために、ぼやけた画像になってしまうという失敗がよくあります。光学系の表面に汚れがないことを常に確認し、クリーニングにはレンズペーパーを使用してください。
標本の水平化
多くの場合、標本の平坦性を心配する必要はありません。ステージは固定式で平坦、標本ホルダーも平坦、そしてスライドも平坦です。
ただし、共焦点検鏡法、TIRF、タイリングなどのように繊細さが求められる適用においては、標本の平坦性が極めて重要になります。標本が傾いていると、シェーディングが発生します。複数の画像を貼り合わせる場合や、画像上の位置によって輝度が変わる場合、シェーディングがアーチファクトの原因になる可能性があります。
標本の平坦性を高める方法の1つは、いくつかのステージインサートに付いている水平調節ネジを使用することです。このネジはステージインサートの角にあります。 水平調整ネジが正しく位置合わせされていないために、サンプルが傾くことはよくあります。 ステージインサートによるサンプルの傾きが気になる場合は、水平調整ネジを完全に外してしまうのがよい方法です。
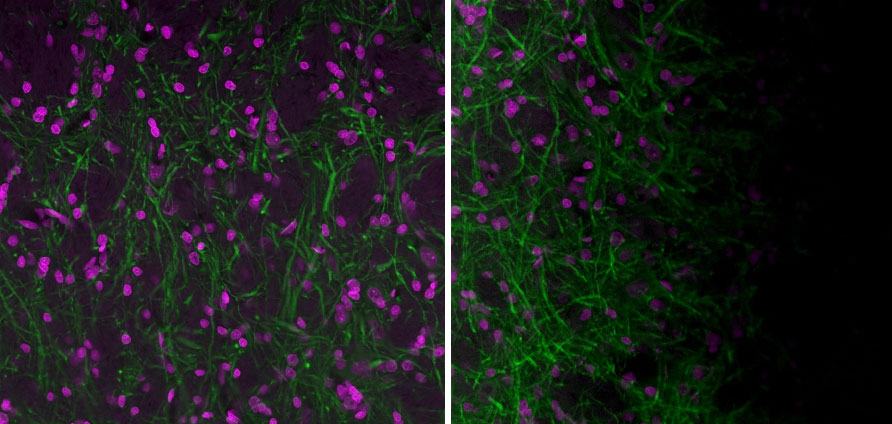
図3:(左):適切に位置合わせされたオリンパスFV3000共焦点レーザー走査型顕微鏡と平らなサンプルで取得された画像。(右):FV3000顕微鏡はうまく位置合わせされているが、サンプルが平らになっていない状態で取得された画像。 シェーディングの原因を特定するのは難しい場合があります。 よくあるのは、サンプルホルダー内でサンプルが平らになっていないために、シェーディングアーチファクトが発生するケースです。 20倍 UPlanXApo対物レンズで取得された画像。 マゼンタはHoechst、緑色はAlexa 488で染色したMAP2(MCA-5H11)。
液浸媒質を決める
オリンパスの対物レンズには、空気(乾燥)、水浸(water immersion/water dipping)、油浸(標準オイル/シリコーンオイル)に対応する主要な5種類があります。間違った液浸媒質を対物レンズに使用すると、画質が低下します。また、オイル用に設計されていない対物レンズの部品にオイルが侵入すると、破損する場合があります。
これらの理由から、使用する対物レンズ用の液浸媒質を知ることは極めて重要です。オリンパスの対物レンズは色分けされているので、必要な液浸媒質を簡単に知ることができ、正しいものを使用できます。
また、ワークフローも考慮してください。60倍のシリコーンオイル浸で撮影してすぐに60倍の水浸対物レンズに切り替えるのは望ましくないかもしれません。シリコーンオイルと水が混ざると、鮮明な画像になりません。さらに、水浸レンズを使用する前に、スライドを取り外してクリーニングする必要があります。
あとは、ご使用の光学系用に設計されている、対物レンズのメーカーと同メーカーのオイルをご使用ください。

図4: 標準オイルであるイマージョンオイルタイプF(左)とシリコンイマージョンオイル(右)。 オリンパスで取り扱う多くのレンズは標準オイル用であり、一部がシリコンイマージョンオイル用となっています。 イメージングを成功させるには、正しいオイルを使用することが重要です。 この2種類のオイルがカバーガラス上で混ざらないようにしてください。
3. 画像を取得する
標本の準備が整い、ここでやっと画像取得ステップに進むことができます。画像取得に役立つヒントをいくつか紹介します。
画像取得のベストプラクティス
共焦点または広視野蛍光観察で画像を取得する場合は、通常、低照明と高い検出感度またはゲインが適しています。 こうすることで、光退色と生体の変化の原因となる有害なレーザーまたはアークランプ照射が低減します。
特定のイオンチャンネルと細胞死経路は、励起光によって活性化する可能性があります。 しかし、適切な画質を生み出すには十分な照明が必要です。 強い照明は美しい画像を作り出すことができます。 励起光と、検出および最終的な実験目標に必要な光のバランスをどのように取るかを考慮してください。
補正環
当社の一部の対物レンズには補正環が付いています。 適切なトレーニングを受けていないと、使用時に混乱する場合があります。 一般的なガイドラインは、次のとおりです。
- カバーガラスなしの場合は0.0、#1.5カバーガラスの場合は0.17を使用します。
- 補正環に温度マークがあるかどうかを確認します。対物レンズによっては、室温か37°Cかによって目盛りが異なります。補正環をセットして撮影を開始し、画像の明るさに焦点を絞りながら、補正環を最適化します。最後のステップには根気と実践が必要です。 調整できない場合は、最初のステップと同様に、補正環の概略記号0.0または0.17のままにしてください。

図5:3種類の60倍対物レンズ。60倍UplanXApo対物レンズ(右)は、標準オイルを使用し、補正環は付きません。60倍UplanApo油浸対物レンズ(左)は、補正環を0.17(#1.5カバーガラス)にセットして使用します。60倍UPlanSApo(中央)は、シリコーンオイルを使用し、補正環を37°C(98.6°F)で0.17(#1.5)にセットします。補正環の位置を最適にすることは、鮮明な画像を得るポイントになります。
コンデンサーの調整
蛍光発光を基本的に利用している場合、通常の顕微鏡操作でコンデンサーは使用されないかもしれません。この場合、コンデンサーハンドルを使用してコンデンサーを標本から離します。
明視野、位相差、DICのイメージングを使用する予定の場合は、通常、コンデンサーのアライメントの検証が最初のステップになります。明視野モードでは、標本にピントを合わせ、次に視野絞りを絞ってコンデンサーの視野絞り像が見えるようにします。このプロセスを容易にするには、10倍または20倍の倍率が適しています。
コンデンサーの視野絞り像が鮮明でない、または中心にない場合は、ケーラー照明を行ってコンデンサーの高さ調節と中心合わせまたはそのいずれかを調整してください。ケーラー照明によるコンデンサーの調整に関する情報を見るには、当社ウェブサイトのMicroscopy Resource Centerをご覧ください。
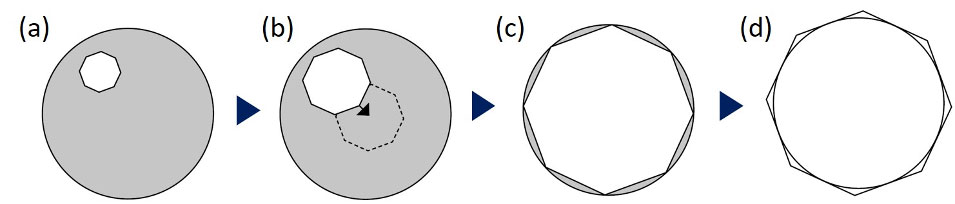
図6:コンデンサーの調整手順:(a) 視野絞りを絞る、(b) 視野絞り像を視野の中心に置く、(c) 正確に中心にあることを確認し、視野絞り像を視野に内接させてから、(d) 視野絞り像を外接させる。
ファイルのサイズ
顕微鏡のファイルは非常に大きくなります。ただし、ファイルサイズを効率化するための策を講じることは可能です。例えば、データが不要な場合に、「念のため」すべて撮影しておこうという考えは、実は無駄を生む原因になります。
必要な解像力、ビット深度、視野を用いて、必要なものだけを撮影します。ファイルを必要以上に大きくすると、データの保存や処理に不要な負荷がかかるため、必要以上のイメージングは避けるようにしましょう。
ファイルの保存
できるだけ速やかにファイルを保存します。コンピューターやハードディスクドライブはいつクラッシュしてもおかしくはないため、複数箇所に保存しましょう。
USBメモリーや外付けハードディスクドライブを使用する際は、注意が必要です。これらのデバイスはウイルスに感染しやすく、ウイルスやマルウェアをコンピューター間で拡散させてしまうおそれがあります。
イメージングシステムのPCに感染が発生してもすぐにはわからず、システムが徐々に、あるいは不規則にクラッシュすることがあります。イメージングシステムの多くは、システムのパフォーマンスを低下させないように、アンチウイルスソフトウェアを入れていません。その結果、イメージングシステムのPCは感染しやすいのです。
これらのリスクを緩和するためには、外付け保存用ドライブをイメージングシステムのPCに接続する前に、そのドライブのスキャンを実行してください。
ファイルフォーマット
オリンパスでは、OIR、OIF、VSI、OIBなどの専用ファイルフォーマットを使用します。これらのフォーマットは、次の特徴を備えています。
- 非圧縮形式のフル解像度画像を提供
- ファイルのアーキテクチャーをオリンパスイメージングシステムに最適な状態に保ちます。
- イメージングパラメーターからメタデータを記録します。
適切なプラグインがインストールされていれば、FIJI/ImageJでこれらのオリンパスファイルを開くことができます。 可能であれば画像はオリンパスのファイル形式で保存することをお勧めしますが、TIFF、JPEG 2000、または他の形式でファイルをエクスポートすべき場合があります。
エクスポートファイルのオプションや画像ファイルの種類によって、圧縮または解像度の低下が起こり得ることにご注意ください。JPEG画像の使用は避けてください。圧縮されることが多く、データロスが起こります。
4. システムを終了する
正しくシステムを終了することは、正しく起動することと同じように重要です。以下にベストプラクティスを示します。
使用後の顕微鏡システムの清掃
イメージング完了後のクリーニングは、丁寧に扱うということだけでなく、ハードウェアの破損予防にもなります。
例えば、油浸対物レンズ用の標準オイルがレンズに残っていると、乾燥して固まってしまう可能性があります。何日も放置されたオイルは、クリーニングが難しく、他の顕微鏡の表面に付着してしまうことも考えられます。 対物レンズの清掃方法については、対物レンズからイマージョンオイルをきれいに落とす6つの秘訣を参照してください。
顕微鏡ステージやイメージングエリアでは、スライドに付いたマニキュアや腐食性の透明化試薬がよく見つかります。 これらの表面、特に液体などの残留物が目に見える箇所をきれいにしてください。 接眼レンズ、タッチパネルコントロール、フォーカスハンドルなどのよく触る表面はすべて、使用者間での汚染や感染の広がりが考えられる部分です。
ウイルスの拡散を低減するため、これらの表面のクリーニングは重要です。タッチパネルや接眼レンズには、エタノール70%の蒸留水をレンズペーパーに含ませて使用することをお勧めします。接眼レンズの周囲に付けられているゴム製のアイキャップは、アルコールによってゴムが劣化しないよう、必ず取り外してください。ステージの表面、エアテーブル、ワークテーブルを、エタノール70%の蒸留水とキムワイプまたは紙タオルでクリーニングすることもお勧めします。
顕微鏡システムを使用前よりきれいな状態にする、という原則を守るとよいでしょう。 イメージング終了後は、顕微鏡から標本をすべて取り除いてください。標本の大部分の最適な保存温度は、37°C、室温、4°C、-20°C、-80°Cのいずれかです。スライドやディッシュの大部分は、破損しないように、また暗所に保存します。標本によっては、細胞インキュベーターに戻さなければならないこともあります。
清掃の詳細については、便利なガイド顕微鏡のクリーニング・消毒方法についてをご覧ください。
顕微鏡システムの電源を切る
システムを正しくシャットダウンすることで、次の2点が確保されます。
- ハードウェアの適切な保守
- 次のユーザーのためのシステム準備
システムを終了する前に、次のユーザーがいつ使用するかを確認します。システムが終了後すぐに使用される予定があれば、ハードウェアをすべて電源オンの状態にしたままログアウトすることも考えられます。ただし、次に使用されるのが1時間以上後なら、システムの電源を切っておくことをお勧めします。こうすることで、レーザー、ランプ、ファン、あるいはその他の使用時間に応じて交換や保守が必要となる構成品の使用時間を短縮することができます。
ハードウェアの電源を切る前に、必ずソフトウェアを終了してください。例えば、ソフトウェアを終了する前に顕微鏡のコントロールボックスをオフにすると、エラーが起こり、次のユーザーの使用時に問題が発生する可能性があります。ソフトウェアはイメージングシステムの頭脳のようなものであることを忘れないでください。
ラボに復帰するためのクイックトラブルシューティングガイド
イメージングについてお困りのことがあれば、いつでもお問い合わせください!顕微鏡科学者がラボに復帰する際によく経験する問題の解決策の例を以下にいくつか紹介します。
問題1:画像がぼやけて見えます。 画像に焦点を合わせることはできますが、くっきりと見えません。
ヒント:エタノール70%の蒸留水をレンズペーパーに含ませ、対物レンズ、カバーガラス、接眼レンズをクリーニングします。カバーガラスが#1.5であることを確認します。最後に、使用している対物レンズに合った液浸媒質を使用しているかどうかを確認します。
問題2:対物レンズを交換しているときに、焦点を完全に失ってしまいました。
ヒント:TPCまたはソフトウェアで同焦点補正が使用可能な場合、その機能が設定されていることを確認します。対物レンズが完全にねじ込まれていることを確認します。対物レンズの液浸に関する要件をチェックします。これには、正しい液浸媒質が使用されていること、他の媒質と混合されていないことの確認が含まれます。低倍率から高倍率に移行する際に焦点調整が必要となるのは異常ではありません。ただし、高倍率から低倍率に移行する際に焦点が失われる場合は、おそらく同焦点に問題があると考えられます。
問題#3:撮像した蛍光画像は、片側が明るく、反対側が暗く見えます。 これでは正しくないように思います。
ヒント:最初に、画像の片側が明るく、反対側が暗いという見え方が、ステージまたは標本のXY軸を置き換えても変わらないかどうかを確認します。その見え方が変わらない場合は、標本が平坦になっていないことが考えられます。標本が平坦な場合は、レーザーまたはアークランプの調整が正しくない可能性があります。問題の原因としてレーザーまたはアークランプが疑われる場合、蛍光励起光路の調整を試す前に、当社のサポート窓口にご連絡ください。お近くのオリンパス販売代理店またはサポートセンターにお問い合わせください。
問題4:画像を別のソフトウェアで開くと、オリンパスのソフトウェアで開いたときのようにきれいに見えません。
ヒント:別にインストールしたオリンパスのソフトウェアでファイルを開くことはできませんか?解像力やメタデータ情報を維持する最も便利な方法は、オリンパスのソフトウェアソリューションでの処理を保つことです。解析ソフトウェアにTIFFやその他の汎用ファイルフォーマットが必要な場合は、加工されていない最大解像度のTIFFファイルを使用してください。これらの加工されていないTIFFファイルは、イメージングソフトウェアで開かない限り黒く見えることがよくあります。また、オリンパスのソフトウェアによっては、画像にズームが適用されている場合に補間を行います。十分なズームが適用されている場合、すべてのソフトウェアが画素を補間するわけではありません。こうしたことから、オリンパスのソフトウェアとFIJI/ImageJで、画像が異なって見えることがあります。
問題5:私の研究室では長年にわたり、#1のカバーガラスを使用しており、研究室内に在庫がたくさんあります。 #1.5のカバーガラスに変更することはどれくらい重要ですか?
ヒント:オリンパスの対物レンズは、水浸レンズを除き、すべて#1.5カバーガラス用に設計されています。対物レンズと標本の間に十分なガラスの厚さがないと、光学アーチファクトが発生することがあります。この点がどの程度問題になるかは、実験内容とイメージングの要件によって変わります。いずれにしても、画像は最大限に解像されず、イメージングが最適なものとはならないと思われます。できるだけ速やかに、#1.5カバーガラスに変更されることをお勧めします。
.jpg?rev=4C75)
