ラボへの復帰の際に共通する懸念は、どのようにして実験の遅れを取り戻すかということです。ソーシャルディスタンシングで貴重な時間が失われたかもしれませんが、実験の加速とスケジュールの維持に役立つスマートな秘訣がいくつかあります。
基本な戦略は、より早く、あるいはマルチタスクで同時並行する、またはその両方で作業を実施することです。しかし、どのようにするのでしょうか。答えは、ハイコンテント実験やハイスループット実験のユニークなアプローチに用いられる概念から学び、これを自分のプロジェクトに適用することです。
ここでは、顕微鏡実験を加速する5つの実践的方法について説明します。
1. より多くのサンプルを観察する
観察するスライドが3枚以上、またはディッシュが3枚以上ある場合、一度に観察してはどうでしょうか。
なぜなら設定が簡単だからです。倒立顕微鏡のステージには、寸法160 × 110 mmのKマウントのようなユニバーサルマウンティング標準品があります。加えて、多くの業者がさまざまなサンプルに対応するステージインサートを提供しています。
実験を同時に実施できるよう複数のディッシュまたは複数のスライドを観察することは手早く簡単な解決策であり、時間の節約となる大きな利点があります。フォーカシング、画像取得の最適化など、最も時間のかかる設定プロセスは複数のサンプルでほぼ同じであるため、このアプローチによってサンプル交換や一般的な実験設定の時間が短縮されます。
現在、施設がソーシャルディスタンシングを実践し、ラボへの出入りを制限し続ける中で、ラボ内にいる時間を短くすることも明らかな利点をもたらします。
2. スピードアップを図る
次に、画像取得速度を最適化します。画像取得を減速させるよくあるボトルネックはフィルターや蛍光キューブの機械的な切り替えプロセスであるため、以下のアイデアについて検討してみる価値があります。
- 画像取得順序を最適化:ZスタックのためにZを移動させる方が蛍光フィルターを変えるより速い場合、蛍光チャンネルを変えず、次のチャンネルに進んで複数のZスタックのために画像を取得した方がよいでしょう(図2中)。
- マルチバンドキューブとLED光源を組み合わせる:最新の顕微鏡技術は妥協のない改善点をいくつか提供しています。LED光源とマルチバンドフィルターの組み合わせはその1つです。各チャンネルのシングルバンド専用フィルターは一般に蛍光の色にじみを防ぐ理想的な解決策ですが、最新のLED光源には色にじみを回避する十分鮮明なスペクトルと迅速な波長切り替え特性があります。これにより、マルチバンドフィルターの利点を活用して画像取得時間を短くすることが可能になります。マルチバンドフィルターを使用するヒントの1つは、可能であればより長い波長でより明るい色素を使用することです。その理由は、色にじみが短い波長(高エネルギー)から長い波長(低エネルギー)まで幅広く発生することにあります。
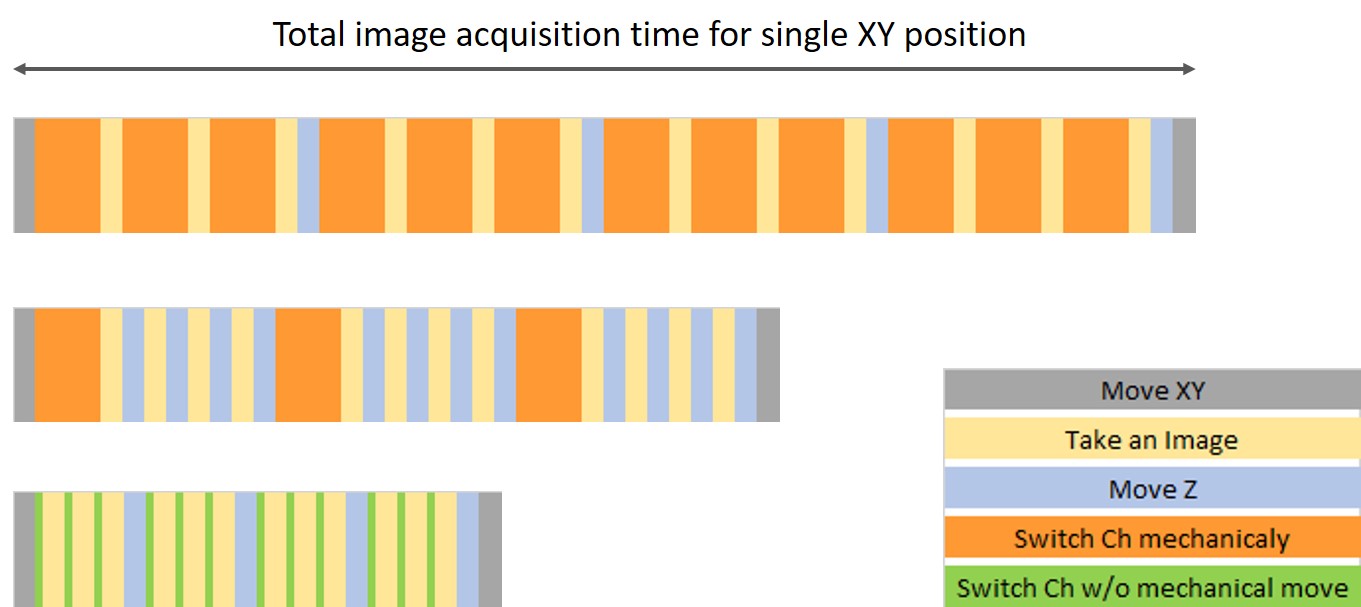
図2:各順序の所要時間を示した画像取得順序のバリエーション。(上)チャンネル> Zの順序。(中)Z >チャンネルの順序。チャンネルを切り替える機械的な動作を減らすことにより、時間を節約できます。(下)チャンネル> Zの順序。チャンネル切り替えの機械的な動作がありません。
- Zスタックの数を削減:もう1つの留意点は、Z取得時間を減らすことです。信頼性が十分高いオートフォーカス機構がある場合、Z位置を多く取得しすぎる必要がなく、画像取得時間を減らして、最終的に励起光による光毒性反応を最小化できます。
3. スループットと画質を両立させる
一般に、最高品質の画像を取得するよう試みる必要があります。なぜなら、画像は主なデータ源であり、ダウンストリーム解析の品質は画質によって決まるからです。しかし、プロジェクトを加速させるためには、実験の目的に必要とされる画質のレベルを検討する必要があります。ここでは、考慮すべき2つのことについて説明します。
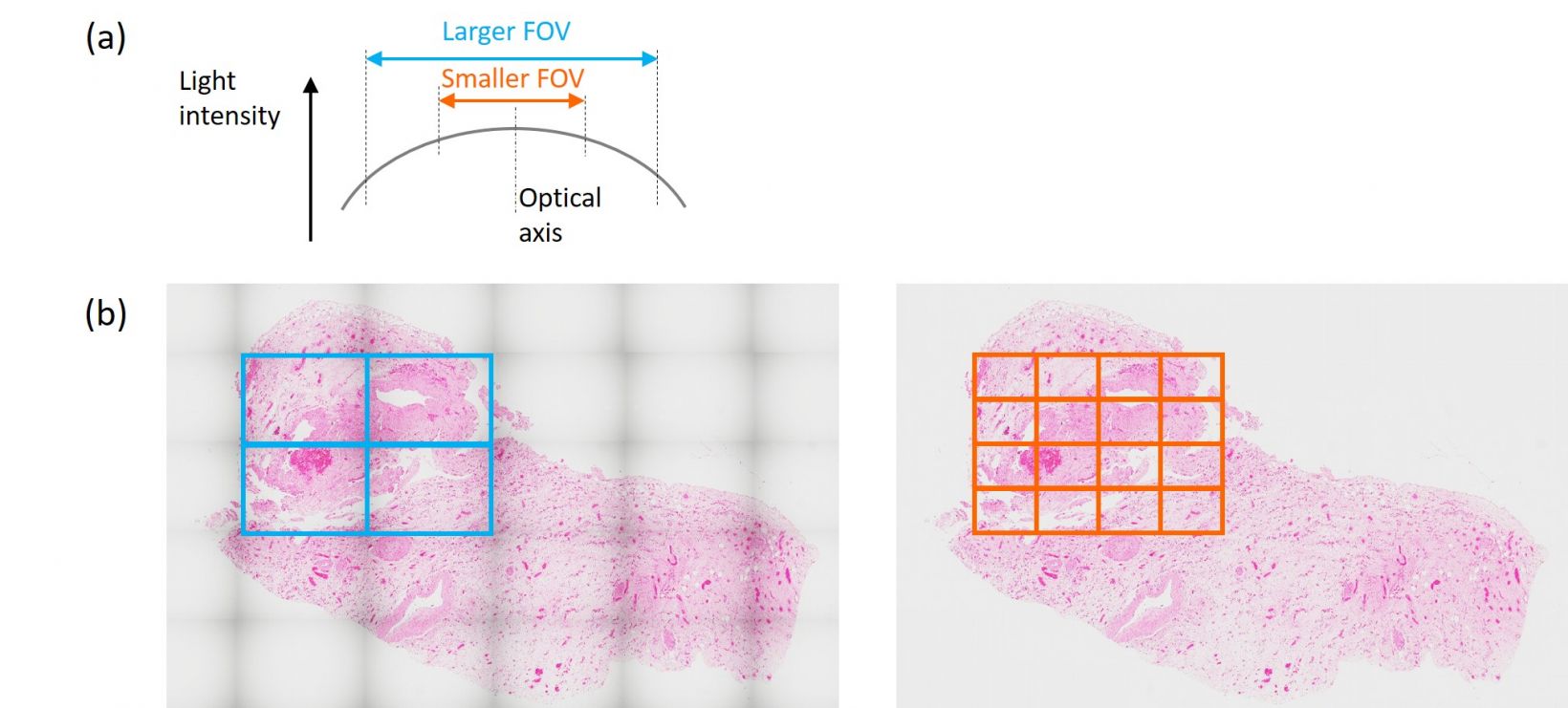
- スピード対品質:画質を優先する場合の主要な妥協点は視野(FOV)と画像取得時間です。視野周辺部を使用しない場合、よりフラットでより均一な画像が得られます。また、これにより、同じ面積をカバーするための画像取得数が増え、所要時間が長くなります。この方法により、シームレスな画像貼り合わせや正確な定量解析が得られ、周辺部の画像のムラへの影響は最小限になります。しかし、完全にシームレスな貼り合わせ画像が不要な場合は、研究に十分な分解能が得られるならば、より広い視野またははるかに低い倍率を用いることを検討してください。スピードと品質の両面で納得できることはないのでしょうか。その場合、視野全体にわたるフラットで均一な画像が得られる最新の高性能対物レンズを使用します。
-
容器の種類:ガラスボトムディッシュまたはプレートが画質のためには最適ですが、ポリスチレンプレートであればコスト削減とより良好な細胞接着が得られます。ここでは、非ガラス容器を選ぶときのヒントについて説明します。
- 容器の種類が画質と作動距離(W.D.)の両方に影響することにご留意ください。プラスチックプレートなど、より厚みのある容器でイメージングを行う場合、通常、より長いW.D.が必要とされます。ほとんどのプラスチック容器は、ガラスボトム容器の0.17 mmより厚く、0.5~1 mmの厚みがあります。より厚みのある容器の場合、W.D.が十分長い対物レンズを必ず使用してください。
- システムとプラスチック容器の互換性を確認してください。例えば、プラスチックの偏光のため、プラスチック容器では微分干渉コントラスト(DIC)を用いることができません。
-
プラスチック容器には、ある程度の自家蛍光があります。自家蛍光の程度が低い場合、背景光はあまり引き起こされませんが、自家蛍光の程度が高い場合、サンプルからの蛍光が覆い隠される可能性があります。実験のために容器を選ぶ前に、特に紫外線または青色励起では自家蛍光を必ず確認してください。
4. データの一貫性と基準点を確認する
多くのサンプルを用いて実験を行う場合、データの一貫性と基準点がデータの信頼性と再現性にとって重要です。これを達成するには、以下のことに留意してください。
- 安定した細胞株を使用する
- 環境均一性(特に温度)が中心部と異なるプレートの周辺部を避ける
- 陽性対照サンプルと陰性対照サンプルを必ず用意する
- 特に室温について環境安定性を確認する
5. 夜間の機会を活用する
ハイコンテントスクリーニングシステムやホールスライドスキャナーのような電動システムや自動システムには、画像取得にバッチ機能が備わっているものもあります。バッチ処理は解析ソフトウェアとも利用可能です。夜間に処理するのに十分なサンプルまたはデータがある場合は、試してみた方がよいでしょう。眠っている間にツールによって実験を続けることができます。
ただ、従業員の安全と健康を確保するために、ラボは毎日方針を変えているため、夜間の実験には想定外のロックダウンや施設の方針の突然の変更のリスクがあるかもしれないことにご留意ください。夜間実験を進める前に、その実施が許可されるかどうかを責任者に忘れずに確認してください。