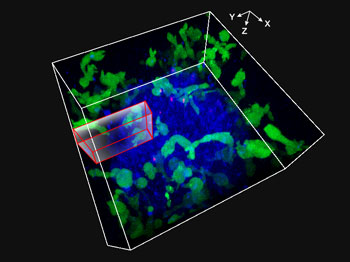
FV3000共聚焦显微镜对细胞球三维延时成像:抗体依赖性细胞介导的细胞毒性作用(ADCC)48小时连续观察
抗体依赖性细胞介导的细胞毒性作用(ADCC)是抗体药物作用的机制之一。诸如自然杀伤(NK)细胞和单核细胞等效应细胞可识别被抗体结合的靶细胞(如肿瘤细胞)。识别抗体后,效应细胞通过释放细胞毒性因子,诱导细胞裂解,破坏靶细胞。本应用中,我们对HT-29细胞(人结肠癌细胞)和表达功能性Fcγ受体的KHYG-1细胞(自然杀伤细胞)进行了三维共培养实验,并使用EGFR标记靶向的治疗性单克隆抗体,在FLUOVIEW FV3000共聚焦显微镜上进行48小时连续观察。由此产生的ADCC三维成像让我们成功捕获NK细胞攻击癌细胞的过程。
以更低光毒性进行3D活细胞球成像
在3D培养系统中生长的细胞球因其厚度而难以成像。最简单的应对方法是提高激发光强度,从而增加荧光亮度,然而高光照强度又不可避免地产生光毒性,对细胞造成损伤。为了解决这一难题,我们使用了奥林巴斯FV3000共聚焦显微镜。FV3000采用TruSpectral全真光谱检测技术,可以更有效地采集3D细胞球内部弱荧光信号,并降低激光的光毒性影响。此外,在深度观察时我们使用60倍硅油物镜,硅油物镜折射率更接近活细胞,比其它类型物镜更容易拍到分辨率更高信号更强的图像。因此,我们成功了捕获48小时的3D细胞球动态变化,并观察到NK细胞介导HT-29细胞死亡。
Related Videos |
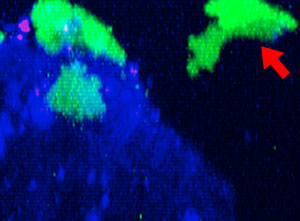
图1:48小时连续观察NK细胞攻击HT-29肿瘤细胞球
将表达功能性Fcγ受体和ZsGreen荧光蛋白的NK细胞系KHYG-1(绿色)与HT-29细胞(人结肠癌细胞)肿瘤球进行共同培养。其中,HT-29细胞用抗EGFR单克隆抗体西妥昔单抗(Alexa Fluor 647,蓝色)标记。在连续48小时XYZT成像过程中,被杀死的肿瘤细胞因为吸收了培养液中的碘化丙啶(PI,死细胞标记物)而呈现红色。
成像条件
物镜:60倍硅油物镜(UPLSAPO60XS)
显微镜:FLUOVIEW FV3000共聚焦显微镜系统
激光:488 nm(ZsGreen,绿色),561 nm(PI,红色),640 nm(Alexa Fluor 647,蓝色)
Z轴防漂移补偿系统实现精确的延时成像
活细胞的长时间成像对于评估抗体药物有效性必不可少。为了更精确地捕获NK细胞对肿瘤细胞球的作用,我们使用Z轴防漂移补偿系统(IX3-ZDC2)来避免因外部环境变化(如温度变化)导致的焦面变化。IX3-ZDC2让我们能够在长达48小时里稳定观察3D肿瘤细胞球观察,并帮助我们鉴定NK细胞在攻击和进入肿瘤块时会主动产生形变。
 9h | 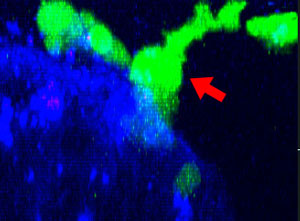 11h | 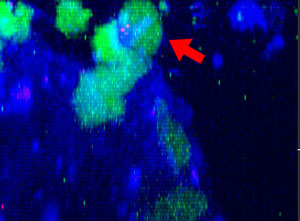 17h | 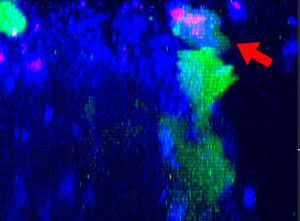 22h | 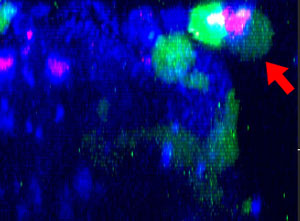 24h |
图2:NK细胞系KHYG-1(绿色)在攻击和杀死以西妥昔单抗(蓝色)标记的HT-29肿瘤细胞时形态会发生变化,PI摄取(红色)代表细胞死亡。
FV3000共聚焦显微镜如何助力我们的实验
全光谱系统实现高灵敏检测
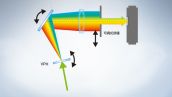
FV3000共聚焦显微镜采用奥林巴斯全真光谱TruSpectral检测技术,通过体相位全息透射光栅提高检测效率。与采用反射型光栅的传统光谱检测单元相比,该技术可实现更高的光通量,并将组织深部观察所需的激光功率降至最低。
利用Z轴防漂移补偿(ZDC)系统保持在焦
IX3-ZDC2 Z轴防漂移补偿系统利用光毒性最低的红外光(1级激光)识别样品焦面。采用一键式自动对焦(AF)模式可根据需要在更厚的样品中设置多个焦面,从而在多点实验中实现高效的Z-stack采集。
Related Videos |
硅油物镜可实现活细胞深度高分辨率观察
硅油折射率(ne≈1.40)接近于活组织的折射率(ne≈1.38),因而能够减少折射率不配的问题,以极小的球差对细胞球或活组织内部进行高分辨率观察。硅油不会挥发,也不易变干或变硬,非常适合活细胞和活组织长时间观察。
Related Videos |
Dr. Yuji Mishima的点评
Dr. Yuji Mishima | 近年来,肿瘤研究中对荧光成像的需求不断增长,特别是3D肿瘤球在临床前药物筛选的应用,可以更直观地检验和评估抗体药物药效。3D细胞球因为厚度的缘故,使用荧光方法也很难观察其内部信息。得益于FV3000共聚焦显微镜,我们能够对3D肿瘤细胞球进行完整的48小时观察。在整个ADCC实验过程中,我们能够准确测量活肿瘤细胞、死细胞和效应细胞(NK细胞)对抗体治疗的反应。我认为FV3000共聚焦系统对于评估抗体药物的治疗效果非常有效。 |
致谢
本应用指南的编写得到以下研究人员的协助:
The Cancer Chemotherapy Center of JFCR, Dr. Yuji Mishima
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。
