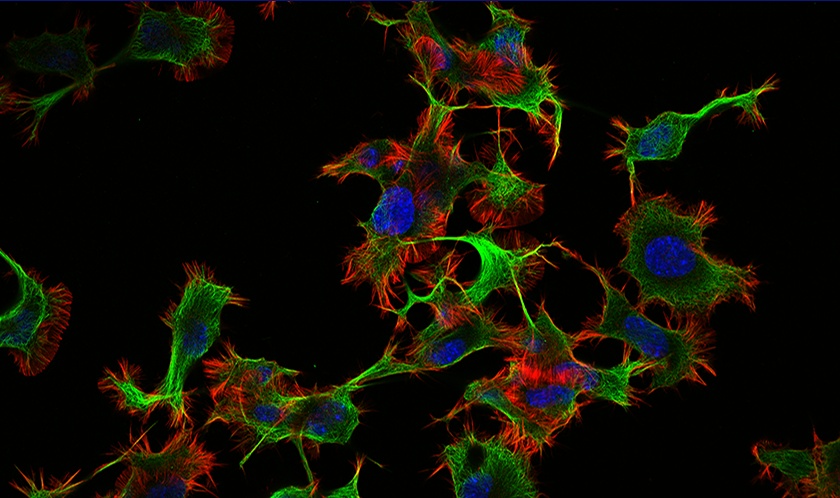
Fluoreszenz-Imaging von Lebendzellen kann knifflig sein, da hochwertige Bilder aufgenommen werden müssen, ohne die Lebensfähigkeit der beobachteten Zellen zu beeinträchtigen. Doch mit den richtigen Mikroskopietools und -techniken führen Sie erfolgreiche Experimente durch und erhalten verlässliche Bilddaten.
Hier sind sechs Tipps, wie Sie beim Fluoreszenz-Imaging von Lebendzellen gute Resultate erhalten.
1. Finden Sie das richtige Mikroskop für Ihre Imaging-Anforderungen.
In puncto Lebendzell-Imaging unterscheiden sich Mikroskope deutlich. Beispielsweise eignen sich inverse Mikroskope gut für das Lebendzell-Imaging, da sie die Probe von unten her abbilden. Auf diese Weise kann die Objektivlinse näher an die lebende Probe herangeführt werden, was bei den meisten Objektiven mit hoher numerischer Apertur (NA) erforderlich ist.
2. Verwenden Sie Kulturschalen mit Deckglasboden.
Kulturschalen mit Kunststoffboden können Eigenfluoreszenz verursachen und das Signal-Rausch-Verhältnis (signal-to-noise ratio, S/N-Verhältnis) verschlechtern. Aus diesem Grund ist es wichtig, beim Fluoreszenz-Imaging von Lebendzellen nach Möglichkeit Kulturschalen mit Deckglasboden zu verwenden.
3. Verwenden Sie Fluoreszenzfilter mit hohen Übertragungsraten, um das S/N-Verhältnis zu verbessern.Eines der wichtigsten Teile der Hardware für Fluoreszenz-Imaging-Experimente an lebendigen Zellen ist der Fluoreszenzfilterwürfel mit den darin enthaltenen Filtern. Suchen Sie nach Filtern mit hohen Übertragungsraten, damit Sie so viel Fluoreszenzsignal wie möglich erfassen können. Dies ermöglicht die Verkürzung der Belichtungszeiten und damit eine Reduzierung des Photobleachings und der Phototoxizität. Olympus Filtermodule sind außerdem mit einer speziellen Beschichtung versehen, die das Streulicht innerhalb des Würfels verringert und das SNR in den Endbildern verbessert. |  Olympus Fluoreszenzfilterwürfel |
4. Verwenden Sie Objektivlinsen mit hoher NA, um mehr Licht zu sammeln und die Belichtungszeiten zu verkürzen.
Eine weitere effektive Möglichkeit, die Belichtungszeit zu verkürzen, ist die Verwendung von Objektiven mit hoher NA. Diese Objektive sammeln bei gleicher Vergrößerung mehr Licht als ihr jeweiliges Gegenstück mit niedrigerer NA. Dies trägt dazu bei, die Belichtungszeiten noch weiter zu verkürzen, was bei Langzeit-Fluoreszenzexperimenten an lebenden Zellen zu einem besseren Zustand der Zellen führt.
Olympus X Line 40x Öl-Objektiv
5. Optimieren Sie Inkubationsmodelle Ihren Versuchsanforderungen entsprechend.
Heute ist eine breite Auswahl an Mikroskopinkubatoren im Handel erhältlich. Ob Sie einen Tischaufsatz oder ein komplettes Mikroskopgehäuse verwenden – stellen Sie sicher, dass Ihr Inkubator allen Anforderungen Ihrer Lebendzellen gerecht wird, also beispielsweise die Möglichkeit bietet, in feuchter Atmosphäre und bei der erforderlichen Gaskonzentration zu arbeiten.
Einige Inkubatoren sind sogar mit Verdunkelungsplatten ausgestattet. Diese verhindern, dass das Mikroskop Raumlicht erfasst, was zur Verbesserung des S/N-Verhältnisses beiträgt.
6. Verwenden Sie Vorrichtungen zur Beibehaltung des Fokus, um die Anzahl der Z-Frames zu reduzieren, die zum Erreichen der korrekten Fokusposition erforderlich sind.
Da sich lebende Proben bewegen, muss sichergestellt werden, dass bei Zeitrafferexperimenten eine ordnungsgemäße Fokussierung erfolgen kann.
Anstatt die Proben durch Z-Stapelung mehreren Beleuchtungen pro Zeitpunkt auszusetzen, sollten Sie eine Driftkompensationsvorrichtung wie unser TruFocus Z-Drift-Ausgleichsmodul verwenden, mit dem der Fokus bei Zeitrafferexperimenten beibehalten werden kann.

Olympus TruFocus Z-Driftkompensator
Ähnliche Themen
Wie man das richtige Mikroskopobjektiv findet: 10 wichtige Fragen
White Paper: X Line-Objektive bieten revolutionäre optische Leistung