多光子励起顕微鏡の概論
多光子蛍光顕微鏡は、レーザー走査型顕微鏡の高度な光学技法と、長波長の多光子蛍光励起を組み合わせて、特殊な蛍光色素で標識された標本の高分解能3D画像を取得する、優れた研究ツールです。

図1:多光子励起蛍光顕微鏡の構成
この方法は、生きた細胞や組織の動態過程を、標本に致命的な損傷を与えずに研究しようと努める細胞生物学者にとって特に有用です。従来の広視野蛍光顕微鏡では、生体の生化学的現象をサブミクロンオーダーの分解能で観察できることが多いものの、焦点面前後の領域一帯に生じる二次蛍光によるバックグラウンドノイズが原因で、感度と空間分解能に限界があります。
多光子顕微鏡の励起は回折限界のある顕微鏡の焦点のみで生じるため、3D分解能を得るため厚い生体標本を光学切片化することができます。個々の光学切片は、X-Y面で標本をラスタースキャンして取得し、連続したZ位置で標本を順次スキャンすることで、完全な3D画像が構成されます。多光子蛍光では焦点位置を正確に定めて制御できるため、標本面の下にある特定領域の観察に役立ちます。励起エネルギーが非常に局所的なので、標本に付着した蛍光色素の退色が最小限になり、光損傷が抑えられます。これによって細胞生存率が上がり、その後に行う生細胞の性質を調べる実験期間を長くすることができます。また、近赤外励起波長を適用することで生体材料に深く浸透でき、短波長に見られる光の高い散乱を抑えられます。これらの利点のおかげで、脳スライス、生きた動物生体内の脳、発生中の胚など、ほかの顕微鏡法では撮像が不可能でないにしても困難な厚い生組織サンプルに対して、実験を行うことができます。
図1は、多光子励起顕微鏡実験で使用される標準的な構成です。顕微鏡は正立型で、小型の実験動物の生体内組織を観察するように設計されています。顕微鏡本体の後部には、チタンサファイアモードロックパルスのレーザーシステムがあります。高いピーク強度があり平均出力が低いため、推奨される多光子励起源の1つとなっています。顕微鏡のレボルバーの近くには、フィルター付きの光電子増倍管検出システムが接続され、散乱した蛍光を対物レンズで効果的に捉えられます。顕微鏡で取得されたデジタル画像は、接続されたコンピューターワークステーションで光学切片から3D再構築を行い、解析できます。
従来の広視野蛍光顕微鏡では、焦点領域外で生じる二次蛍光が、フレアや高いバックグラウンドノイズ信号の原因となり、重要な標本の細部がぼんやりとしてしまいがちです。共焦点顕微鏡では、ピンホール開口を使用して焦点外のバックグラウンド蛍光を遮断することで、この問題を大幅に改善し、厚い標本の奥深くにある、薄い(1ミクロン未満)鮮明な切片画像が得られます。多光子励起顕微鏡は、豊富な種類の検出器と組み合わせて励起源を選択して、共焦点顕微鏡の代わりに導入できます。従来の共焦点顕微鏡とは異なり、図1の顕微鏡では3D識別を行うための検出器をピンホールの近くに設置する必要がなく、照射された蛍光信号の効率が大幅に高くなります。かつては、多光子励起に高いコストと複雑なパルスレーザーシステムを要していたため、この技法の使用は限られていました。近年は、すぐに使えるレーザーと市販の多光子システムのおかげで、多光子励起顕微鏡法は多くの研究に選ばれるようになっています。
二光子および三光子励起
多光子励起の基本原理はマリア・ゲッパート・メイヤーによって、70年以上前に博士論文研究の中で初めて論じられ、その仮説が確認されたのは約30年後にルビーレーザーが発明されてからでした。高い光子密度において、2つの光子はエネルギーを合わせることで(仮想状態を経て)同時に吸収され、蛍光色素が励起状態になる電子遷移を引き起こします。光子のエネルギーは波長に反比例することから、2つの光子の波長は、一光子励起に必要な波長の約2倍になります。例えば、波長が640ナノメートル(赤色光)である2つの光子を合わせて、320ナノメートル領域(紫外光)の紫外光吸収蛍光を励起でき、より長い波長(青または緑)の二次蛍光の発光が生じます。この特異な応用は、より長い波長(赤外域まで)を利用して単一量子現象で発色団を励起できることを意味し、これに続いてより低い波長で二次放射が発せられます。
2つの光子それぞれの励起現象の計算には、励起強度の2乗による速度定数が必要です。多光子励起では光子の波長が同じになる必要はありませんが、多くの実験システムは単一のレーザー源を使用して設計されているため、通常2つの光子は共に狭い波長分布を持つ明確な集団を構成します。一光子吸収の場合とは異なり、特定の蛍光色素が2つの光子を同時に吸収する可能性は、入射光子の空間的・時間的オーバーラップの関数となります。各蛍光色素が同じレーザー交点で照射されると仮定した場合の計算では、光子は互いに10(-18)秒(1アト秒)以内に到達する必要があることを示します。このオーバーラップ期間の時間尺度は、中間の仮想状態の寿命(10(-17)秒、つまり0.01フェムト秒)と一致します。
多光子励起で蛍光励起を十分に行うには、高い光子密度が必要です。実際、光子密度は、一光子吸収に必要な数値の約百万倍なければなりません。これは、パルスピーク時に大量の電力を生成しつつ、標本を損傷しない平均出力の低さを備えた、高出力モードロックパルスのレーザーを使用すれば実現可能です。レーザーが発する短いながら強力なパルスによって、一定の平均入射レーザー出力レベルで、特定の蛍光色素における平均二光子吸収効率が高くなります。平均励起出力レベルを最小限にすると、一光子吸収量は低減し、同じことは励起中の標本にも起こります。これが一光子励起で見られる現象であり、蛍光実験中に発生する加熱の大部分と光損傷の一部を引き起こします。
標準的なパルスレーザー構成では、多光子励起実験に80~100 Mhzの繰り返し周波数でおよそ100フェムト秒(10 e(-13)秒)の短いデューティサイクルを用いています。この構成により、標本に過度な熱と光損傷を与えることなく、申し分のない画像を取得できます。各パルスの時間尺度は「超短」と呼ばれる一方で、二光子吸収の反応時間よりも4、5桁長くなっています。二光子パルスによって励起される発色団の一重項状態の数は、従来の広視野顕微鏡や共焦点蛍光顕微鏡で取得されるものと同じです。したがって、二光子励起後に発せられる二次蛍光は、一光子励起で見られるものと区別できません。ローダミンなどの蛍光色素は、一光子と二光子のどちらで励起されたかにかかわらず、広い波長域の二次蛍光を発します。
三光子励起は、二光子励起と似た方式で起こりうる相関する非線形光学吸収現象です。異なる点は、三光子では、励起一重項状態への遷移を誘導するために、蛍光色素と同時に相互作用する必要があることです。三光子励起の利点は、正常な吸収に必要な光子密度を、二光子吸収より10倍だけ大きくすればよいことであり、この点が一部の実験にとって有利になっています。三光子励起では、二光子吸収よりもZ軸分解能を強化できます。これは、3つの個々の光子との同時相互作用に求められる、より小さい蛍光色素励起の交点のおかげです。実際、波長分布の中心が1050ナノメートルの赤外光を発するレーザーは、紫外域(およそ350ナノメートル。励起波長の3分の1)で吸収する蛍光色素を励起できます。同じレーザーは、半分の波長(525ナノメートル)で別の蛍光色素を同時に励起でき、二重標識による生物実験に便利な組み合わせです。
三光子励起に短い近赤外波長(最短720ナノメートル)を使用すると、深い紫外域まで蛍光イメージングを拡張できます。900~700ナノメートルのレーザー波長では、240~300ナノメートル域で吸収される蛍光色素を励起しますが、これは従来の顕微鏡光学系ではほとんどアクセスできません。蛍光対物レンズの製造で使用されるガラスは、300ナノメートルを下回る波長に対する透過性が非常に低くなっていますが、より長い波長の赤外レーザー光はたやすく透過し、三光子励起を誘導できます。
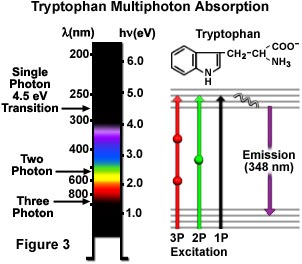
図3は、一般的な芳香族アミノ酸であるトリプトファンの一光子、二光子、三光子励起を図式化したものです。4.5電子ボルトの一光子電子遷移は、280ナノメートルでトリプトファンを励起し、その後に紫外域の348ナノメートルで二次蛍光が発せられています。二光子励起は580ナノメートルを中心とする黄緑色の光で誘導され、三光子励起はアミノ酸が近赤外域の840ナノメートル光で照射されると誘導されます。遷移はヤブロンスキー図(図3)に示すとおり、二光子励起については1つの球、三光子励起については2つの球で仮想状態が表されています。トリプトファンは他の芳香族アミノ酸よりも量子収率の高い強力な蛍光色素を持ち、大半のタンパク質にごく少量存在します。こうした特性から、トリプトファン残基の自家蛍光を利用した研究において、多光子顕微鏡は優れたツールとなっています。四光子励起など、さらに高次の非線型現象も可能ですが、生物学研究には現在のところ応用されていません。
二光子励起顕微鏡
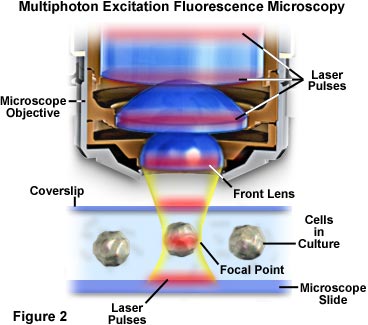
多光子顕微鏡において、焦点付近の領域に励起が局在化するのは、そこの光子密度が最も高いためです。この利点は、蛍光色素による二光子吸収が励起強度の2乗の関数であるという基本的な物理原則によります。パルスレーザー源から発せられた光子に高い開口数の対物レンズで焦点を当てると、光子はさらに密集するため、2つ以上の光子が同時に単一の蛍光色素と相互作用する可能性が高くなります。多くの励起が生じる場所は顕微鏡の焦点領域のみなので、多光子吸収においてここに光子が集中していることは重要です。この多光子励起の概念を巨視的・微視的に表した図が、それぞれ図2と図4です。図2は、顕微鏡用スライドとカバースリップの上から培養細胞を撮像するために適切な位置に設定された、顕微鏡対物レンズの拡大図を表しています。赤色レーザーパルスが対物レンズの縦軸を通り抜け、集束して図の中心部にある細胞に集中しています。
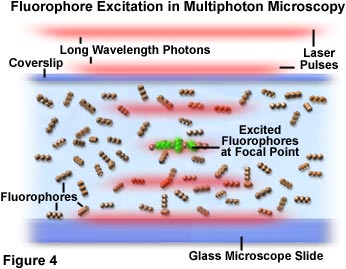
図4では、押し寄せて蛍光色素と交差する光子が顕微鏡焦点に描かれています。赤色レーザー光のパルスが蛍光色素(線状に連なった3つの球)を含む標本を通り抜けると、パルスが対物レンズの焦点に到達して励起の確率が上昇します。個々の光子は、レーザーパルスの境界を定める赤色の広がる線に分けられた集合体として表されています。図4の焦点領域の中心にある蛍光色素分子の小さなグループが、2つの光子の同時吸収によって励起され、緑色の二次蛍光を発しています。焦点面外の光子密度は高くないため、この領域にある発色団が2つの光子を吸収する確率はほぼゼロです。
二光子励起の現象が起こるのは顕微鏡焦点にある蛍光色素の空間的近接によるだけではなく、連続するレーザーパルスに含まれる光子の時間的オーバーラップの影響も受けます。前述のように、二光子吸収の励起エネルギーの発生は、レーザー源で生成された光子強度の2乗に比例します。パルスレーザー光の強度は焦点面からの距離の2乗に比例して低下するので、焦点領域付近にある蛍光色素の励起確率は、焦点面からの距離の4乗に比例して低下します。パルスレーザー光円錐の大きさは、対物レンズの開口数で決まります。したがって、焦点から離れた光の強度の低下は、励起光円錐の直径の2乗に比例します。光円錐が焦点の上下に広がると、蛍光色素の励起確率は円錐直径の4乗に比例して低下します。このため、蛍光色素励起は焦点付近の領域に限定され、標本全体のうち非常に薄い光学切片のみに励起が見られることになります。
通常は約100フェムト秒~1ピコ秒(10 e(-13)~10 e(-12)秒)であるレーザーパルス幅は、巨視的には非常に短いと見なされます。しかし、光子吸収現象(フェムト秒の約1000分の1)の時間尺度で見ると、パルスの持続時間は実際にはかなり長いです。これによって蛍光色素の飽和は制限され、次の励起が起こるまでのパルス間に分子が基底状態に戻る十分な時間があります。パルスの繰り返し周波数は80~120メガヘルツ(MHz)で、励起に必要な高い瞬時ピーク出力と、それに続く平均10ナノ秒の滞留時間が提供されます。標準的な蛍光色素の蛍光寿命は数ナノ秒しかないため、励起分子の集団にはパルス間に緩和する時間が十分にあります。比較的短いパルスデューティサイクル(パルス幅をパルス間の時間で割ったもの)によって、平均入射レーザー出力の値は、共焦点レーザー走査型顕微鏡に通常採用されている値よりわずかに大きいだけです。
二光子励起は焦点面付近の領域に対して制限されますが、このことは多光子顕微鏡が共焦点顕微鏡を上回る大きな利点です。共焦点顕微鏡では標本全体で蛍光が励起されますが、検出器で収集される二次蛍光は共焦点ピンホールによって対物レンズの焦点面に制限されます。したがってバックグラウンドノイズの量や、データにバックグラウンドノイズを付加する他の焦点面からの蛍光が低減します。それに対して、多光子顕微鏡では焦点面のみで蛍光励起(およびその後の蛍光発光)が生じるため、バックグラウンド信号も共焦点ピンホールの必要性もなくなります。共焦点顕微鏡と多光子顕微鏡の励起モードの大きな違いを示したのが図5で、それぞれの技法の光退色の形状がわかります。
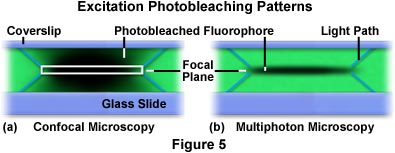
図5では、蛍光色素ローダミン(緑染色)で染色されたフォルムバール高分子フィルムの単一X-Y面を繰り返しスキャンして生じた、X-Z光退色パターンが示されています。左(図5(a))は、共焦点顕微鏡で染色フィルムをスキャンして生成された形状です。スキャンの中心にある白い長方形は、ピンホールを通過して検出器で撮像された焦点面を表しています。この長方形の上下の角から出ている青い斜めの線は、フィルム越しに励起光が辿った光路を表しています。レーザー光がフィルムをスキャンすると、蛍光色素が励起されて二次蛍光を発します。徐々に光退色が生じますが、これは焦点領域の暗い部分で表されています。共焦点顕微鏡でスキャンされたフィルム(図5(a))で、全体の励起は、焦点面の上下の励起光路を通してほとんど同じです。対照的に、多光子顕微鏡で生成されたX-Z繰り返しスキャンによる励起形状では、励起と光退色が焦点面に限定されています(図5(b))。図5(a)の場合と同様に、焦点面から出た青い斜めの線は、励起光が焦点面に達するまでに辿った光路を表しています。
多光子顕微鏡で可能になる局所的な励起には、いくつもの利点があります。おそらく最も大きな利点は、この技法で実現する高度な3D分解能で、理想的な共焦点顕微鏡で取得されるものと同じです。また、焦点面の外側にある蛍光色素による吸収がないため、より多くの励起光が標本内を通って焦点面まで到達できます。その結果、集束ビームが標本内の奥深くまで入り込む能力が大幅に向上し、共焦点顕微鏡による観察の2~3倍の深さになることがよくあります。
前述のように、焦点領域外の多光子吸収確率は、光軸(Z方向)に沿った距離の4乗に比例して低下します。均一に分布した蛍光色素が高い開口数(1.4)の対物レンズで多光子励起を受けると、焦点ボリュームという厳密に定められた空間で吸収の約80%が行われます。このボリュームの大きさは対物レンズの開口数によって異なりますが、標準的な大きさの開口数を持つ蛍光対物レンズで近赤外波長を使用する場合、この領域は横寸法0.3ミクロン径、軸長1ミクロンの楕円体で定義されます。
図5(b)に示されている多光子顕微鏡の光退色量(および関連する細胞や組織への光損傷)は、共焦点顕微鏡で発生する量を大幅に下回ります。光退色と光損傷は、生きた細胞、組織、その他の有機体の研究において、蛍光顕微鏡の最も重大な制限事項のうちの2つに挙げられます。蛍光色素の励起は、基底状態の電子から励起一重項状態への遷移を誘導します。励起状態から振動緩和状態の間、通常の一重項基底状態に戻る代わりに、三重項状態への項間交差が発生する可能性があります。三重項状態は非常に反応が速く、比較的寿命が長いため、この状態にある蛍光色素は生細胞と作用することも、分子の変性や非蛍光種への再配列を経ることもできます。さらに、励起三重項状態の蛍光色素は、隣接する生体分子の各種官能基と反応する一重項酸素を生成できます。励起光は焦点までのすべての焦点面で標本に侵入し、この光のほとんどは焦点領域を超えてかなりの距離を伝搬し続けます。したがって、広視野顕微鏡や共焦点顕微鏡の場合と同様に、ビーム路程全体で励起された蛍光色素の集団はかなりの光退色を受け、細胞や組織の損傷が生じますが、これは多光子技法で回避できます。
光にさらされて生じる細胞損傷の正確なメカニズムは十分に解明されていないものの、光損傷を減らすと、蛍光顕微鏡で研究する生物サンプルの生存率が大幅に拡大することが明らかになっています。長波長の可視光や近赤外光のみにさらしても、細胞生存率には影響が見られないため、多光子顕微鏡に関する損傷の大部分は励起によるもので、焦点面に限定されています。
多光子顕微鏡の検出器
多光子顕微鏡において、二次蛍光で発せられる光子は、ほぼすべて対物レンズの焦点面から生じるため、内部検出器の必要がなく、より柔軟な検出構造が可能になります。この多用途性の向上は、共焦点顕微鏡に比べて蛍光検出効率の大きな改善につながります。内部検出器を持つシステムの場合、対物レンズで集められた光は一連の走査ミラーの表面で反射してから、ピンホールを通って検出器まで到達します。画像の分解能は向上する一方で、共焦点ピンホールによって検出効率が大きく低下し、標本を入射照明に長くさらさざるを得ないため、光損傷と光退色の可能性が高くなります。
検出効率を最大にするには、外部検出器を対物レンズのそばに配置し、光路の直径を大きくして、サンプル内部の深いところからの散乱蛍光信号を効果的に検出する必要があります。多光子顕微鏡によく使用される検出器は光電子増倍管(PMT)です。ガリウムヒ素リン(GaAsP)PMT検出器を装備すると、標準的なマルチアルカリPMTより量子効率が高いため、かすかな蛍光からでもSN比の高い画像を取得できます。

図6
多光子顕微鏡の分解能
多光子顕微鏡の分解能が共焦点顕微鏡の分解能を上回ることはありません。実際、より長い波長(赤色から近赤外光、つまり700~1200ナノメートル)を使用すると、多光子励起ではより大きな点広がり関数になります。この結果、横方向と軸方向のどちらの分解能もやや低下します。例えば、励起波長が700ナノメートル、開口数1.3の対物レンズの場合、観察される横方向分解能は約0.2マイクロメートルで、対応する軸方向分解能は0.6マイクロメートルです。ストークスシフトサイズと組み合わせると、これらの値は従来の共焦点顕微鏡を使用して同一条件で観察した場合の分解能より最大30%大きくなります。実際、共焦点分解能を低下させる可能性があるものは、有限径ピンホール開口、色収差、光学系の不完全な配置などですが、これらのすべてが共焦点顕微鏡と多光子顕微鏡の分解能の差を縮めるのに役立ちます。このことから、共焦点顕微鏡で構造が適切に解決されていない場合、多光子励起でのイメージングが公平でなくなります(悪化する可能性があります)。
デジタル画像の取得や3D空間分解能での光子カウントを行う場合、焦点ボリューム内で生じた蛍光発光とバックグラウンドで生じたものを区別することが欠かせません。この2つの信号の区別は、装置的に行うか(共焦点または多光子顕微鏡)、3Dデータセットのデコンボリューションにより行うことができます。焦点面からの蛍光発光とバックグラウンド蛍光を区別する能力は、SB比(S/B)で定義されます。ここで、Sは焦点面から収集された光子の数または強度を表し、Bはバックグラウンド(焦点面以外)からの光子を表します。共焦点顕微鏡の場合、共焦点ピンホールでバックグラウンド信号を排除すると、高いSB比が得られます。しかし多光子励起の場合、焦点面以外の励起がほとんどないため、SB比は本質的に高くなります。多光子法と共焦点法の分解能計算を比較するには、共焦点の計算を行うときに非常に小さいピンホールを考慮します。どちらの技法でも、SB比は従来の広視野顕微鏡より桁違いに大きくなります。
もう1つ考慮する点は、多光子励起では低い波長の紫外光域で吸収遷移する蛍光色素を利用できるということです。共焦点顕微鏡では蛍光色素の励起が約340ナノメートルに制限されるため、研究者はより長い波長のプローブを使用する傾向にあり、相応に分解能が低くなります。クリティカルな局面では、共焦点ピンホールにより撮像波長を制限するとともに、CCDフォトダイオードアレイなどの空間分解検出システムをスキャン像面に配置して多光子顕微鏡の分解能が強化されます。
蛍光色素の励起の特徴
多光子励起で使用される蛍光色素は、一光子励起の場合と同様の精査を受けます。プローブに求められるのは、適度な波長での大きな吸収断面積、高い量子収率、低い光退色率、できる限り低い化学毒性・光化学毒性です。また、蛍光色素はレーザー源からの高輝度の光に耐えつつ、大きな劣化は避けなければなりません。ほとんどの場合、広視野顕微鏡や共焦点顕微鏡でマーカーとして広く用いられているものと同じ、二光子励起用の一般的な蛍光色素が使用されています。
一般的な蛍光色素の励起スペクトルは、入射光子の励起モードと波長の関数です。この依存性により、二光子吸収スペクトルは対応する一光子スペクトルとは(多くの場合)大きく異なる可能性があります。実験に基づき、研究で使用されている蛍光色素の多くは、一光子の最大吸収波長の2倍の二光子励起を吸収できます。それにもかかわらず、単純に一光子断面積を調べることで複雑な蛍光色素の二光子励起スペクトルを定量予測するための基本的原則はありません。大きな違いがよく見られるのは、高度に共役した非対称性分子の一光子および二光子励起スペクトルで、励起状態の構造に関する情報を得るために分子分光学で多く利用されます。そのよい例が芳香族アミノ酸誘導体であるチロシンとフェニルアラニンで、複雑な二光子断面積は一光子励起で表示されているものとはかなり異なっています。対称的に、トリプトファンの二光子スペクトル(図2)は一光子励起の表示形状によく似ています。
定量的3D再構築とデコンボリューション実験の場合、蛍光色素の二光子吸収スペクトルを測定して、励起波長が吸収帯域のピーク付近に中心を置いていることを確認する必要があります。二光子断面積は計算できますが、その処理はなお複雑です。吸収スペクトルを実験で直接測定できればいいですが、これは光源の強度変動に対して、吸収される入射光量が少ないので困難です。吸収断面積の測定には熱レンズ法や音響光学法が利用されていますが、おそらくもっと簡単なのは、既知の量子収率を持つ蛍光色素からの光子放出を調べる方法です。新たな二光子実験を設計するときは、蛍光色素の量収率範囲を調べて、吸収ピークを目的の励起波長の半分の値付近にする必要があります。
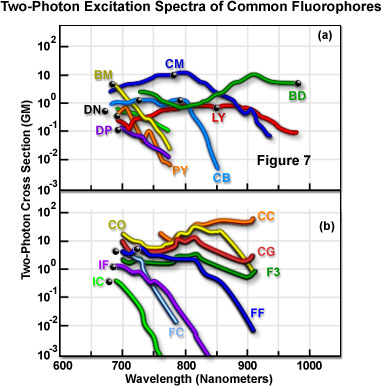
図7は、多数の一般的な蛍光色素について、測定された二光子励起スペクトルの特徴を表しています。図7のデータは二光子反応断面積を表していて、蛍光発光量子効率と二光子吸収断面積の積から得られたものです。スペクトルの記録には、モードロックチタンサファイアレーザーから照射する直線偏光が使用されました。各スペクトルにおいて、黒い点は蛍光色素の一光子吸収最大波長の2倍を表します。表1は、図7の各スペクトルの横に示されている2文字の名前コードの手がかりです。曲線は、蛍光色素の二光子励起におけるスペクトル断面を表しています。
蛍光色素の二光子励起スペクトル
| 蛍光色素名(略語) | 励起波長(ナノメートル) |
|---|---|
| (BM) p-bis (o-methylstyryl) benzene | 691 |
| (CB) Cascade Blue hydrazide trisodium salt | 750 |
| (YL) Lucifer Yellow CH ammonium salt | 860 |
| (BD - Bodipy) 4,4-difluoro-1,3,5,7,8-pentamethyl-4-bora-3a, 4a-diazaindacene-2,6-disulfonic acid disodium salt | 920 |
| (DP - DAPI not DNA bound) 4',6-diamidino-2-phenylindole dihydrochloride | 700 |
| (DN - Dansyl) 5-dimethylaminonaphthalene-1-sulfonyl hydrazine | 700 |
| (PY) 1,2-bis-(1-pyrenedecanoyl)-sn-glycero-3-phosphocholine | 700 |
| (CM) coumarin 307 | 776 |
| (IC) indo-1 with Ca++ | 700 |
| (IF) indo-1 without Ca++ | 700 |
| (FC) fura-2 with Ca++ | 700 |
| (FF) fura-2 without Ca++ | 720 |
| (CG) Calcium Green-1 with Ca++ | 725 |
| (CO) Calcium Orange with Ca++ | 800 |
| (CC) Calcium Crimson with Ca++ | 850 |
| (F3) fluo-3 with Ca++ | 800 |
表1
断面積の測定値は、二光子吸収の励起ピークが、一光子の形状によく似ている、つまり青方偏移する傾向があることを示しています(図7)。利用可能なモードロックレーザーの波長範囲に蛍光励起を組み合わせるには、より短い平均波長の方が有利なことがあります。そのほかに二光子吸収スペクトルが持つ一貫性のある側面としては、一光子吸収スペクトルよりもだいぶ広範囲にわたるということです。励起に適した波長範囲が広がることで実験的制約が緩和されるとともに、二光子断面積は重なっているが一光子スペクトルは広く分かれている、2つの蛍光色素が同時に励起する能力が高まります。三光子断面積の測定値は、概して、対応する一光子スペクトルによく似ていることを示しています。
一光子励起と二光子励起では吸収スペクトルが異なることが多いものの、その他の傾向特性(寿命、発光波長、項間交差率など)に影響は見られません。この類似性は、線形吸収でも非線形吸収でも同じ蛍光励起状態に到達することと、ひとたび励起した蛍光色素は励起モードに関係なく同じように振る舞うことを示しています。こうした性質は三光子励起でも同様で、研究者は多くの多光子実験で確立されたレシオメトリック法や分光法を利用できます。
多光子励起による光損傷と熱損傷
どの形式の蛍光顕微鏡でも生細胞への光損傷は見られますが、その度合いは、細胞プローブとして使用される蛍光色素の励起波長、暴露期間、科学的性質によって異なります。励起光による損傷は、熱損傷と、化学反応による劣化の2種類に分けられます。蛍光色素励起による生物化学反応が原因の光化学副作用は、まだ十分に解明されておらず、細胞や組織の種類によってさまざまです。一方で熱損傷は、原則的に2つのメカニズムで発生します。水による一光子吸収と、焦点領域での蛍光色素からの二光子吸収です。
ほとんどの細胞研究(特に哺乳類細胞)では、多光子励起に用いられる内在性蛍光色素で、長波長の近赤外励起光はほとんど吸収されません。しかし、細胞内水や細胞・組織の周囲にある細胞間水は、かなりの量の赤外光と近赤外光を吸収する場合があり、これが過熱を引き起こして生物標本の生存率を低下させる可能性があります。一方で、共焦点顕微鏡や広視野顕微鏡に用いられる短波長の可視光と紫外光で、水性生物環境を照らす場合、熱の大部分は周囲の水に吸収されません。
水の一光子吸収による熱は、焦点面の上下ともに、ビーム路程の至るところで発生します。制御された平均的な多光子条件下で誘発される温度上昇は、700ナノメートル~1000ナノメートルで0.065℃~1.1℃の範囲と計算されています。この計算は、光ピンセットのレーザー励起を使用して1064ナノメートルで行った熱測定と一致します。励起光が固定されている場合、大幅な加熱が生じて、時間と対数的に急上昇するおそれがあります。多光子励起の場合、蛍光色素吸収による加熱は焦点領域に局在化します。それに続く放熱は、焦点ボリューム周辺の球対称域内で均一に発生し、蛍光色素密度が高い場合でも、大量の熱が生成されることはありません。
まとめ
多光子励起顕微鏡法は、生きた実験動物の細胞や組織の動態イメージングに選ばれる方法の1つになっています。この技法が特に有用なのは、サンプル内の深い場所にある細胞の動態を観察する場合です。さらに、多光子励起では光退色と光損傷が最小限になり、焦点ボリュームのすぐそばにある領域のみで発生する、といった副次的効果もあります。
細胞の光毒性は十分に解明されていない現象ですが、ほとんどの形式の蛍光顕微鏡で高い頻度で発生します。多光子顕微鏡で使用されている低い量子エネルギーと長波長の低い固有吸収は、生きた細胞や組織に対する光の悪影響の低減に役立ち、細胞動態の研究への道を開きます。多光子顕微鏡による研究の主な障害は機器のコストが高いことで、二光子および三光子励起に必要なモードロックパルスレーザーシステムは特に高価です。一般に使用されている最も人気のある超高速レーザーシステムは、チタンサファイアレーザーです。チタンサファイアパルスレーザーは波長選択性があることから(700~1300ナノメートル)、広い用途に対応します。この有用性によって、生物科学分野のいたるところでこの技法が広く応用されるでしょう。
このページはお住まいの地域ではご覧いただくことはできません。



