Introdução à microscopia de fluorescência multifotônica
A microscopia de fluorescência multifotônica é uma ferramenta poderosa de pesquisa que combina as avançadas técnicas ópticas da microscopia de varredura a laser com a excitação de fluorescência multifotônica em comprimento de onda longo, capturando imagens tridimensionais em alta resolução de espécimes marcados com fluoróforos altamente específicos.

Figura 1. Configuração de microscópio de fluorescência por excitação multifotônica
A metodologia é particularmente útil para profissionais da biologia celular que desejam estudar processos dinâmicos em células e tecidos vivos sem promover danos significativos (e muitas vezes letais) ao espécime. Embora o microscópio clássico de fluorescência de campo amplo costume ser capaz de fornecer resolução submicrônica de eventos bioquímicos em sistemas vivos, a técnica tem limitações em termos de sensibilidade e resolução especial devido ao ruído de fundo causado por fluorescências secundárias nas áreas situadas acima e abaixo do plano focal.
Na microscopia multifotônica, a excitação só ocorre no ponto focal de um microscópio limitado por difração, proporcionando a capacidade de particionar opticamente espécimes biológicos grossos a fim de obter uma resolução tridimensional. Cada corte óptico é adquirido mediante o escaneamento por varredura do espécime no plano x-y, enquanto uma imagem totalmente tridimensional é composta pelo escaneamento serial do espécime em posições z sequenciais. Como é possível determinar e controlar com exatidão a posição do ponto focal, a fluorescência multifotônica é útil para a sondagem das regiões selecionadas além da superfície do espécime. A energia de excitação altamente localizada serve para minimizar o fotobranqueamento dos fluoróforos vinculados ao espécime e reduz o fotodano, aumentando a viabilidade celular e a duração subsequente dos experimentos que pesquisam as propriedades de células vivas. Além disso, a aplicação de comprimentos de onda de excitação no intervalo do infravermelho próximo permite uma penetração superior nos materiais biológicos, além de reduzir o alto grau de dispersão da luz que é observado em comprimentos de onda mais curtos. Essas vantagens permitem que os pesquisadores conduzam experimentos em amostras grossas de tecido vivo, como cortes de cérebro ou cérebro vivo de animal in vivo e embriões em desenvolvimento, algo que seria difícil ou até impossível de capturar com outras técnicas de microscopia.
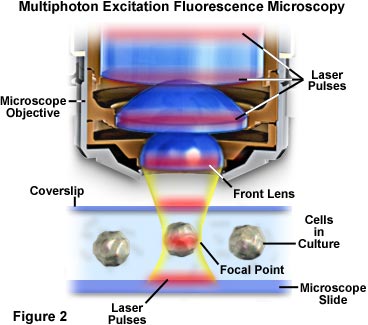
A Figura 1 ilustra uma configuração habitual usada em experimentos de microscopia de fluorescência multifotônica. O microscópio é um instrumento que fica na posição vertical e foi desenvolvido para observar tecido vivo de pequenas animais experimentais in vivo. O lado posterior do corpo do microscópio é um sistema de laser pulsado em titânio-safira com bloqueio de modo que representa uma das fontes preferenciais para excitação multifotônica devido ao alto pico de intensidade, mas baixa energia média. Essa posição tem um sistema filtrado de detecção de fotomultiplicador conectado de maneira suficientemente próxima da porta-objetiva do microscópio para detectar a fluorescência dispersa efetivamente capturada pela objetiva. As imagens digitais coletadas pelo microscópio são processadas e analisadas por uma estação de trabalho computacional anexa que pode montar reconstruções tridimensionais com base nos cortes ópticos.
A microscopia tradicional de fluorescência de campo amplo é afetada pela fluorescência secundária que ocorre longe da região focal e que contribui para um alargamento e um alto sinal de ruído de fundo, que muitas vezes oculta detalhes importantes do espécime. Ao usar aberturas do tipo pinhole, a microscopia confocal contorna uma boa parte desse problema ao rejeitar a fluorescência de fundo que esteja fora do foco, o que produz cortes ópticos finos (menos de um mícron) e não borrados de grandes profundidades em espécimes grossos. A introdução da microscopia de fluorescência multifotônica fornece uma alternativa à microscopia confocal por meio da excitação seletiva acoplada a uma maior variedade de opções de detecção. Ao contrário dos microscópios confocais convencionais, o microscópio apresentado na Figura 1 não exige um pinhole próximo ao detector para fazer a discriminação tridimensional, aumentando drasticamente a eficiência dos sinais de fluorescência emitida. Anteriormente, o alto custo e a complexidade dos sistemas de laser pulsado necessários para a excitação multifotônica limitavam o uso da técnica. Hoje em dia, sistemas de laser e multifotônicos comerciais prontos para uso fizeram da microscopia de fluorescência multifotônica o método preferencial para muitas pesquisas.
Excitação com dois e três fótons
Os princípios básicos da excitação multifotônica foram inicialmente descritos pela PhD Maria Göppert-Mayer durante a pesquisa de sua tese de doutorado há mais de 70 anos, mas não foi possível confirmar a hipótese até a invenção do laser de rubi pulsado, aproximadamente 30 anos depois. Em altas densidades de fótons, é possível absorver (com mediação de um estado virtual) dois fótons simultaneamente ao combinar suas energias para provocar a transição eletrônica de um fluoróforo para o estado excitado. Como a energia de um fóton é inversamente proporcional ao seu comprimento de onda, os dois fótons devem ter comprimentos de onda com aproximadamente o dobro do que é necessário para a excitação de um só fóton. Como exemplo, é possível combinar dois fótons com um comprimento de onda de 640 nm (luz vermelha) para excitar um fluoróforo absorvente de ultravioleta na região de 320 nm (ultravioleta), o que resultará na emissão de fluorescência secundária em comprimentos de onda mais longos (azul ou verde). Essa aplicação singular significa que é possível utilizar comprimentos de onda mais longos, chegando até a região do infravermelho, para excitar cromóforos em um só evento quântico que emitirá subsequentemente radiação secundária com comprimentos de onda mais baixos.
O requisito de dois fótons para cada evento de excitação requer uma taxa constante que depende do quadrado da intensidade de excitação. Embora os fótons não precisem ter comprimentos de onda idênticos para induzir a excitação multifotônica, a maioria dos sistemas experimentais é projetada com uma só fonte de laser. Sendo assim, normalmente os dois fótons fazem parte de uma população definida com uma distribuição de banda estreita dos comprimentos de onda. Diferente do caso de absorção de fóton único, a probabilidade de que um determinado fluoróforo absorva simultaneamente dois fótons é uma função da sobreposição espacial e temporal entre os fótons incidentes. Cálculos realizados com base na suposição de que cada fluoróforo seja exposto à mesma seção de choque de laser indicam que os fótons devem chegar com 10(-18) segundos (um atossegundo) de diferença entre eles. A escala de tempo desse período de sobreposição é consistente com a vida útil (10[-17] segundos ou 0,01 femtossegundo) do estado virtual intermediário.
Na fluorescência multifotônica, é necessário ter altas densidades de fótons para garantir um nível suficiente de excitação de fluoróforo. Na verdade, a concentração de fótons precisa ser de aproximadamente um milhão de vezes a concentração necessária para um número equivalente de absorções de um só fóton. Isso é realizado por meio de lasers pulsados de modo bloqueado de alta potência, que geram uma quantidade significativa de energia durante os picos de pulso, mas têm uma potência média que é suficientemente baixa para não danificar o espécime. Os pulsos curtos, porém, intensos, emitidos pelo laser aumentam a probabilidade média de absorção de dois fótons para um determinado fluoróforo em um nível médio constante de energia do laser incidente. A minimização do nível médio de potência de excitação reduz a quantidade de absorção de fóton único, que também ocorre no espécime durante a excitação. Os eventos de excitação de um só fóton resultam na maior parte do aquecimento e de uma parcela do fotodano que ocorrem durante experimentos com fluorescência.
As configurações comuns de laser pulsado usam ciclos curtos de operação de aproximadamente 100 femtossegundos (10 e[-13] segundos), com uma taxa de repetição de 80 a 100 megahertz para experimentos de fluorescência multifotônica. Esse regime permite uma aquisição satisfatória de imagem sem submeter o espécime a uma quantidade excessiva de calor e fotodano. Embora normalmente chamada de “ultracurta”, a escala de tempo para cada pulso ainda é de 4 a 5 ordens de magnitude maior do que o tempo de reação para a absorção de dois fótons. A população de estados singleto em cromóforos excitados por um pulso de dois fótons é idêntica à população obtida durante a microscopia convencional de fluorescência confocal ou de campo amplo. Portanto, a emissão de fluorescência secundária após a excitação de dois fótons é indistinguível daquela observada em experimentos com um só fóton. Um fluoróforo, como a rodamina, emitirá o mesmo intervalo de comprimento de onda amplo de fluorescência secundária independentemente de ter sido excitado por um evento de excitação com um ou dois fótons.
Diagrama de Jablonski para excitação multifotônica
Descubra como eventos de excitação de fluorescência ocorrem na microscopia de um, dois e três fótons utilizando o clássico diagrama de Jablonski.
A excitação de três fótons é um evento relacionado de absorção óptica não linear que pode ocorrer de maneira semelhante à excitação de dois fótons. A diferença é que existe a necessidade da interação de três fótons com um fluoróforo para elicitar uma transição para o estado excitado singleto. Um dos benefícios da excitação de três fótons é que uma absorção bem-sucedida requer apenas uma concentração dez vezes maior de fótons em relação à absorção de dois fótons, tornando essa técnica atrativa para alguns experimentos. A excitação de três fótons é capaz de aprimorar a resolução no eixo z em níveis ainda superiores em relação à absorção de dois fótons. Isso se dá por uma seção de choque menor para excitação de fluoróforos causada pelo requisito para interação simultânea com três fótons individuais. Na prática, um laser que emita luz infravermelha com uma distribuição de comprimento de onda centralizada em 1050 nm é capaz de excitar um fluoróforo com absorção na região ultravioleta (aproximadamente 350 nm, ou 1/3 do comprimento de onda de excitação). O mesmo laser é capaz de excitar simultaneamente outro fluoróforo na metade do comprimento de onda (525 nm), uma combinação útil em experimentos biológicos com marcação dupla.
Ao utilizar comprimentos de onda mais curtos de infravermelho próximo (indo até 720 nm), a fluorescência de três fótons pode ampliar o alcance útil das imagens de fluorescência até o ultravioleta profundo. Comprimentos de onda de laser no intervalo de 900 a 700 nm excitará os fluoróforos que absorvem na região de 240 a 300 nm, virtualmente inacessível usando óptica microscópica convencional. O vidro usado na fabricação de objetivas de fluorescência tem transmissão muito baixa para comprimentos de onda inferiores a 300 nm, mas a radiação mais longa, no comprimento de onda infravermelho, passa facilmente pelo vidro para produzir a excitação de três fótons.
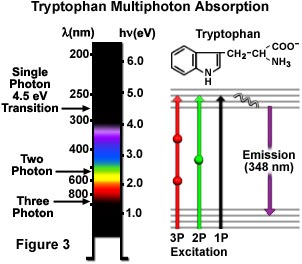
As excitações do triptofano (um aminoácido aromático comum) com um, dois e três fótons são ilustradas de maneira esquemática na Figura 3. Uma transição eletrônica de fóton único com 4,5 elétron-volt excita o triptofano a 280 nm, com a emissão subsequente de fluorescência secundária a 348 nm na região ultravioleta. A excitação pelo mecanismo de dois fótons é concretizada com luz amarela-esverdeada centralizada em 580 nm, enquanto a excitação de três fótons ocorre quando o aminoácido é iluminado com radiação em 840 nm na região do infravermelho próximo. As transições são apresentadas em um diagrama de Jablonski (Figura 3), com o estado virtual representado por uma esfera para excitação por dois fótons e duas esferas para excitação por três fótons. O triptofano tem fluorescência muito mais forte com um rendimento quântico superior do que qualquer outro aminoácido aromático e está presente apenas em pequenas quantidades na maioria das proteínas. Esses atributos devem fazer da microscopia multifotônica uma excelente ferramenta para investigações usando a autofluorescência de resíduos de triptofano. Também é possível obter fenômenos não lineares de ordem superior, inclusive excitação de quatro fótons, mas ainda não há aplicação em pesquisa biológica.
Microscopia de fluorescência de dois fótons
A localização da excitação na região imediatamente ao redor do ponto focal na microscopia multifotônica ocorre porque esse ponto concentra a mais alta densidade de fótons. Essa vantagem é decorrente do princípio físico básico de que a absorção de dois fótons por um fluoróforo é uma função do quadrado da intensidade da excitação. Quando os fótons de uma fonte de laser pulsado são focados por uma objetiva com alta abertura numérica, eles ficam mais comprimidos, aumentando assim a probabilidade de que dois ou mais interajam simultaneamente com um só fluoróforo. A concentração de fótons no ponto focal do microscópio é tão crucial para a absorção multifotônica que essa é a única região na qual há a ocorrência de excitação substancial. O conceito é apresentado nas Figuras 2 e 4, que ilustram a excitação multifotônica em um nível macroscópico e microscópico, respectivamente. A Figura 2 ilustra uma visualização exagerada de uma objetiva de microscópio posicionada para formar imagem de células cultivadas em uma lâmina de microscópio e lamínula. Os pulsos de laser vermelho atravessam o eixo longitudinal da objetiva e são focados e concentrados sobre a célula na parte central da figura.
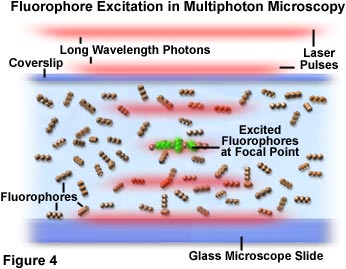
Na Figura 4, a concentração dos fótons e interação com fluoróforos é demonstrada no ponto focal do microscópio. Conforme os pulsos da luz do laser vermelho passam pelo espécime que contém fluoróforos (representados como um tripleto linear de esferas), a probabilidade de excitação aumenta conforme os pulsos atingem o ponto focal da objetiva. Cada fóton é representado como um agregado segregado em linhas vermelhas difusas que definem os limites dos pulsos de laser. Um pequeno grupo de moléculas de fluoróforos posicionado no centro da região focal na Figura 4 foi excitado pela absorção simultânea de dois fótons e está exibindo fluorescência secundária verde. Como a densidade de fótons não é suficientemente alta nessa região, a probabilidade de que cromóforos fora do plano focal absorvam dois fótons é praticamente zero.
O fenômeno da excitação de dois fótons é possível não somente por causa da proximidade espacial dos fluoróforos no ponto focal do microscópio, mas também graças à sobreposição temporal dos fótons contidos em pulsos de laser sequencial. Como mencionado acima, a energia de excitação na absorção de dois fótons ocorre proporcionalmente ao quadrado da intensidade de fótons produzida pela fonte de laser. A intensidade do feixe de laser pulsado diminui como o quadrado da distância do plano focal, de modo que a probabilidade de excitação de um fluoróforo em qualquer região próxima da região focal diminui na quarta potência da distância do fluoróforo em relação ao plano focal. As dimensões do cone de iluminação do laser pulsado são determinadas pela abertura numérica da objetiva. Portanto, longe do ponto focal, a intensidade do feixe diminui de maneira proporcional ao diâmetro do quadrado do cone da luz de excitação. Conforme o cone de iluminação se expande acima e abaixo do ponto focal, as probabilidades de excitação do fluoróforo diminuem na quarta potência do diâmetro do cone. Por esse motivo, a excitação do fluoróforo está confinada à região imediatamente ao redor do ponto focal, representando apenas um corte óptico muito fino de todo o espécime.
Eventos na região de excitação
Explore eventos que ocorrem na região focal do microscópio durante a excitação do espécime usando iluminação com laser infravermelho próximo e visível de comprimento de onda longo.
As durações do pulso de laser, que normalmente variam de aproximadamente 100 femtossegundos a 1 picossegundo (10 e[-13]) a (10 e[-12]), são consideradas ultracurtas em termos macroscópicos. No entanto, em termos da escala de tempo para eventos de absorção de fótons (aproximadamente um milésimo de um femtossegundo), os pulsos tem duração relativamente longa. Isso limita a saturação de fluoróforos e permite que as moléculas tenham tempo suficiente para retornar ao estado fundamental entre os pulsos antes de outra rodada de excitação. As taxas de repetição de pulso variam de 80 a 120 megahertz (MHz), o que proporciona alta energia de pico instantâneo para excitação, seguida por um tempo médio de interrupção de 10 nanossegundos. Como a vida útil de fluorescência de um fluoróforo comum dura apenas alguns nanossegundos, a população de moléculas excitadas tem bastante tempo para relaxar entre os pulsos. O ciclo de trabalho de pulso relativamente curto (o tempo de duração do pulso dividido pelo tempo entre os pulsos) limita a potência média de entrada do laser a um valor ligeiramente maior do que o habitualmente usado para microscopia confocal de varredura a laser.
A limitação da excitação de dois fótons à região próxima ao plano focal fornece uma vantagem significativa para a microscopia multifotônica em relação à microscopia confocal. Na microscopia confocal, a fluorescência é excitada em todo o espécime, mas o pinhole confocal restringe ao plano focal da objetiva a fluorescência secundária coletada pelo detector. Isso serve para reduzir a quantidade de ruído de fundo ou fluorescência de outros planos focais que adicionam ruído de fundo aos dados. Por outro lado, a microscopia multifotônica gera excitação de fluorescência (e, subsequentemente, emissão de fluorescência) somente no plano focal, eliminando tanto o sinal de fundo quanto a necessidade de um pinhole confocal. A diferença drástica entre os modos de excitação nas microscopias confocal e multifotônica é ilustrada na Figura 5, que analisa os perfis de fotobranqueamento para cada técnica.
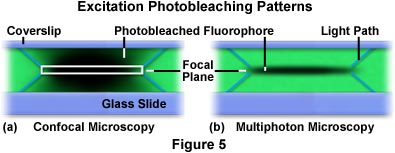
A Figura 5 apresenta os padrões de fotobranqueamento x-z que ocorrem após o escaneamento repetido de um só plano x-y em um filme polimérico de formvar tingido com o fluoróforo rodamina (corante verde). No lado esquerdo (Figura 5[a]), você pode ver o perfil gerado ao usar um microscópio confocal para o escaneamento do filme tingido. O retângulo branco no centro do escaneamento representa o plano focal que passa pelo pinhole e cuja imagem é formada pelo detector. As linhas diagonais na cor azul projetadas a partir das quinas inferior e superior do retângulo representam o caminho óptico do feixe de luz de excitação no filme. Conforme o feixe varre o filme, o corante fluorescente é excitado e emite fluorescência secundária. Eventualmente, o fotobranqueamento ocorrerá, sendo representado pelas áreas escuras na região focal. No filme escaneado pelo microscópio confocal (Figura 5[a]), a excitação integrada é praticamente igual ao longo do caminho de excitação, tanto acima quanto abaixo do plano focal. De modo oposto, o perfil de excitação de escaneamento repetitivo x-z gerado pelo microscópio multifotônico limita a excitação e o fotobranqueamento do plano focal (Figura 5[b]). De modo semelhante ao caso da Figura 5(a), as linhas diagonais na cor azul que partem do plano focal delineiam o caminho seguido pela luz de excitação até alcançar o plano focal.
A excitação localizada proporcionada pela microscopia multifotônica garante diversas vantagens. Talvez a mais importante delas seja o alto grau de resolução tridimensional que a técnica permite alcançar, sendo idêntico ao obtido com um microscópio confocal ideal. Além disso, a ausência de absorção dos fluoróforos posicionados fora do plano focal permite que mais da luz de excitação penetre no espécime e alcance o plano de foco. Isso resulta num aumento drástico da capacidade que o feixe focado tem de penetrar profundamente no espécime, frequentemente alcançando profundidades que podem variar de duas a três vezes os valores atingidos na microscopia confocal.
Como discutido anteriormente, a probabilidade de absorção multifotônica fora da região focal cai na quarta potência da distância ao longo do eixo óptico (a direção z). Quando uma distribuição uniforme de fluoróforos é submetida à excitação multifotônica com uma objetiva de alta abertura numérica (1.4), aproximadamente 80% da absorção ocorre em um espaço restritamente definido e chamado de volume focal. As dimensões desse volume dependem da abertura numérica da objetiva, mas para uma objetiva de fluorescência com abertura grande em comprimentos de onda no infravermelho próximo, essa área é definida por um elipsoide com uma dimensão lateral de 0,3 mícrons de diâmetro e um comprimento axial de 1 mícron.
Padrões de branqueamento de excitação
Compara os padrões de fotobranqueamento induzidos pela excitação que ocorrem próximo à região focal nos sistemas de microscopia multifotônica e confocal.
A redução significativa na quantidade de fotobranqueamento (e do fotodano associado nas células e tecidos) ilustrada na Figura 5(b) para a microscopia multifotônica demonstra que esse método proporciona imagens com níveis de interferência substancialmente menores do que o observado na microscopia confocal. O fotobranqueamento e o fotodano são duas das limitações mais importantes da microscopia de fluorescência no estudo de células, tecidos e outros organismos vivos. A excitação de um fluoróforo causa a promoção de um elétron em estado fundamental para um estado energético excitado singleto. Durante o relaxamento vibracional do estado excitado, há uma probabilidade de que a passagem intersistemas ocorra para um estado tripleto em vez do habitual declínio de volta para o estado fundamental singleto. Os estados tripleto são extremamente reativos e relativamente duradouros, o que permite que os fluoróforos nessa condição tenham tempo de reagir com células vivas ou passar por degeneração ou reorganização molecular para uma espécie não fluorescente. Além disso, os fluoróforos excitados em um estado tripleto podem gerar um oxigênio singleto, que reagirá com uma ampla variedade de grupos funcionais em biomoléculas vizinhas. A luz de excitação precisa penetrar o espécime em todos os planos focais no caminho até o plano focal, e a maior parte dessa luz continua se propagando até uma distância considerável após a região focal. Portanto, uma população de fluoróforos excitados ao longo do caminho do feixe, como no caso da microscopia confocal e de campo amplo, passará por uma quantidade considerável de fotobranqueamento e produzirá dano celular e tecidual que pode ser evitado com a técnica multifotônica.
Embora os mecanismos exatos de dano celular induzido por exposição à luz sejam pouco compreendidos, estabeleceu-se que a diminuição do fotodano ampliará drasticamente a viabilidade de amostras biológicas investigadas com microscopia de fluorescência. A exposição apenas à luz no infravermelho próximo e visível de comprimento de onda longo não parece afetar a viabilidade celular. Portanto, é provável que a maioria do dano associado à microscopia multifotônica seja decorrente da excitação e fique confinado ao plano focal.
Detectores para microscopia multifotônica
Na microscopia multifotônica, os fótons emitidos por meio de fluorescência secundária têm origem quase que exclusivamente do plano focal da objetiva, eliminando a necessidade de detecção descanned e possibilitando geometrias flexíveis de detecção. Esse aumento da versatilidade pode resultar em uma melhora considerável na eficiência de detecção de fluorescência em comparação à microscopia confocal. Em um sistema com detecção descanned, a luz coletada pela objetiva é refletida a partir da superfície de uma série de espelhos de escaneamento antes de passar por um pinhole até o detector. Enquanto aumenta a resolução da imagem, o pinhole confocal produz uma grande redução na eficiência de detecção e precisa de exposição mais demorada do espécime à iluminação incidente, elevando a probabilidade de fotodano e fotobranqueamento.
Para maximizar a eficiência de detecção, normalmente os detectores non-descanned estão localizados perto da lente objetiva, e o diâmetro do caminho da luz precisa ser maior para detectar efetivamente o sinal de fluorescência disperso de grandes profundidades na amostra. O tubo fotomultiplicador (Photomultiplier tube, PMT) é um detector comum para a microscopia multifotônica. Quando equipado com detectores de PMT de fosfeto de arsenieto de gálio (Gallium arsenide phosphide, GaAsP), é possível adquirir imagens com alta proporção entre sinal e ruído, mesmo de fluorescência fraca, devido à sua maior eficiência quântica em relação aos PMTs multialcalinos padrão.

Figura 6
Resolução na microscopia multifotônica
Na microscopia multifotônica, a resolução não ultrapassa os valores alcançados pela microscopia confocal. Na verdade, a utilização de comprimentos de onda mais longos (vermelho ao infravermelho próximo; 700 a 1.200 nm) resulta em uma função mais ampla de dispersão de ponto para a excitação multifotônica. Isso se traduz em uma leve redução nas resoluções lateral e axial. Por exemplo, com um comprimento de onda de excitação de 700 nm e uma objetiva com abertura numérica de 1.3, a resolução lateral observada é de aproximadamente 0,2 micrômetros, com uma resolução axial correspondente de 0,6 micrômetros. Quando integrados ao tamanho da mudança de Stoke, esses valores podem alcançar até 30% a mais do que a resolução observada sob condições idênticas na microscopia confocal convencional. Na prática, a resolução confocal pode ser degradada pela abertura finita do pinhole, aberração cromática e alinhamento imperfeito do sistema óptico. Cada um desses aspectos atua para reduzir as diferenças de resolução entre as microscopias confocal e multifotônica. Com base nessa discussão, fica aparente que se estruturas não forem adequadamente resolvidas com um microscópio confocal, elas não terão um melhor desempenho (e talvez até pior) em projeções com excitação multifotônica.
Ao coletar imagens digitais ou contar fótons com resolução especial tridimensional, é essencial diferenciar entre a emissão de fluorescência que ocorre no volume focal e a emissão de fluorescência que tem origem em segundo plano. É possível fazer a diferenciação entre os dois sinais por meio de instrumentos (com instrumentação confocal ou multifotônica) ou por meio da deconvolução de um conjunto de dados tridimensional. A capacidade de diferenciar entre a emissão de fluorescência do plano focal e a fluorescência em segundo plano é definida pela proporção entre sinal e fundo (signal-to-background, S/B), na qual S é o número ou a intensidade dos fótons coletados do plano focal e B representa os fótons originados no fundo (planos fora do foco). Na microscopia de varredura confocal, o pinhole confocal gera altas proporções S/B ao rejeitar o sinal de fundo. No entanto, na excitação multifotônica, as proporções S/B são inerentemente amplas pois há pouquíssima excitação fora do plano focal. É possível comparar cálculos de resolução entre as técnicas multifotônica e confocal considerando um pinhole infinitamente pequeno durante os cálculos confocais. Para ambas as técnicas, a proporção entre sinal e fundo costuma ser várias ordens de magnitude maior em relação à microscopia de fluorescência de campo amplo.
Outro ponto que deve ser considerado é que a excitação multifotônica viabiliza a utilização de fluoróforos com transições de absorção na região ultravioleta de comprimento de onda curto. Como a microscopia confocal tem capacidade limitada de excitar fluoróforos abaixo de aproximadamente 340 nm, as pesquisas tendem a utilizar sondas com comprimentos de onda muito mais longos e, consequentemente, resoluções mais baixas. Em situações críticas, é possível melhorar a resolução na microscopia multifotônica restringindo os comprimentos de onda da formação de imagem por meio de um pinhole confocal e também utilizando um sistema de detecção com espacialmente resolvido, como um arranjo de fotodiodos de dispositivo acoplado por carga posicionado no plano de uma imagem escaneada.
Características de excitação de fluoróforos
Os fluoróforos usados em experimentos multifotônicos devem ser submetidos ao mesmo rigor daqueles destinados a pesquisas com um só fóton. As sondas devem ter grandes seções de choque de absorção em comprimentos de onda convenientes, altos rendimentos quânticos, uma baixa taxa de fotobranqueamento e o menor grau possível de toxicidade química e fotoquímica. Os fluoróforos também devem ser capazes de suportar iluminação de alta intensidade proveniente da fonte de laser sem apresentar níveis significativos de degradação. Na maioria dos casos, os investigadores utilizaram os mesmos fluoróforos comuns para experimentos com dois fótons que já são amplamente aplicados como marcadores em microscopia de fluorescência confocal e de campo amplo.
O espectro de excitação de fluoróforos comuns é uma função do modo de excitação e do comprimento de onda dos fótons incidentes. Por causa dessa dependência, o espectro de absorção de dois fótons pode (e costuma acontecer) diferir drasticamente do espectro correspondente de fóton único. Sob o ponto de vista experimental, a maioria dos fluoróforos que foram examinados é capaz de absorver excitação de dois fótons no dobro do comprimento de onda de sua absorção máxima de um fóton. Apesar disso, não há uma base fundamental para prever de maneira quantitativa o espectro de excitação de dois fótons de um fluoróforo complexo mediante a simples avaliação da seção de choque de fóton único. O espectro de excitação de moléculas não simétricas conjugadas costuma apresentar diferenças significativas para um e dois fótons. Essas diferenças são bastante exploradas na espectroscopia molecular a fim de fornecer informações sobre a estrutura dos estados excitados. Os aminoácidos aromáticos derivados tirosina e fenilalanina são um bom exemplo. Suas seções de choque complexas de dois fótons são significativamente diferentes das seções exibidas por excitação com um só fóton. Por outro lado, o espectro de dois fótons para o triptofano (Figura 2) é muito semelhante ao perfil exibido para a excitação com um só fóton.
Para experimentos de deconvolução e reconstrução tridimensional quantitativa, o espectro de absorção de dois fótons dos fluoróforos deve ser medido a fim de garantir que os comprimentos de onda de excitação sejam centralizados perto dos picos nas bandas de absorção. Embora seja possível calcular as seções de choque de dois fótons, na melhor das hipóteses, trata-se de um processo complexo. O método preferencial é a medição experimental direta dos espectros de absorção, no entanto, esses são experimentos difíceis de realizar devido à baixa quantidade de energia incidente absorvida em relação às flutuações de intensidade na fonte de luz. A determinação das seções de choque de absorção já usou lentes térmicas e técnicas acústico-ópticas. Porém, talvez um método mais simples seja examinar a emissão de fótons provenientes de fluoróforos com um rendimento quântico conhecido. Ao desenvolver novos experimentos com dois fótons, deve-se analisar uma gama de fluoróforos com picos de absorção próximos ao valor da metade do comprimento de onda de excitação planejado.
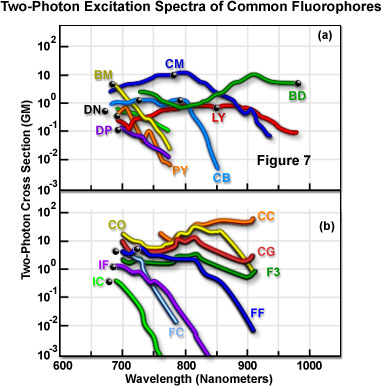
A Figura 7 apresenta as características dos espectros de excitação de fluorescência com dois fótons para diversos fluoróforos comuns. Os dados na Figura 7 representam as seções de choque de ação de dois fótons, derivadas com base no produto da eficiência quântica de emissão de fluorescência e a seção de choque de absorção de dois fótons. Os espectros foram registrados com luz polarizada linearmente emitida por um laser de titânio/safira com bloqueio de modo. Em cada espectro, o ponto preto representa o dobro do comprimento de onda do máximo de absorção de fóton único do fluoróforo. A Tabela 1 apresenta os códigos de nome com duas letras que estão ao lado de cada espectro na Figura 7. As curvas representam as seções de choque espectrais de excitação de fluoróforo com dois fótons.
Espectros de excitação de fluorescência de dois fótons dos fluoróforos
| Nome do fluoróforo (abreviação) | Comprimento de onda de excitação (nanômetros) |
|---|---|
| (BM) p-bis (o-metilestiril) benzeno | 691 |
| Sal trissódico hidrazida Cascade Blue (CB) | 750 |
| Sal de amônio de CH Lucifer Yellow (YL) | 860 |
| Sal dissódico de ácido 4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a, 4a-diazaindaceno-2,6-dissulfônico (BD - Bodipy) | 920 |
| Dicloridrato 4',6-diamidino-2-fenilindol (DP - DAPI não ligado a DNA) | 700 |
| Hidrazina 5-dimetilaminonaftaleno-1-sulfonil (DN - Dansyl) | 700 |
| 1,2-bis-(1-pirenedecanoil)-sn-glicero-3-fosfocolina (PY) | 700 |
| Cumarina 307 (CM) | 776 |
| Indo-1 com Ca++ (IC) | 700 |
| Indo-1 sem Ca++ (IF) | 700 |
| Fura-2 com Ca++ (FC) | 700 |
| Fura-2 sem Ca++ (FF) | 720 |
| Cálcio Green-1 com Ca++ (CG) | 725 |
| Cálcio Orange com Ca++ (CO) | 800 |
| Cálcio Crimson com Ca++ (CC) | 850 |
| Fluo-3 com Ca++ (F3) | 800 |
Tabela 1
As medições de seção de choque indicam uma tendência na qual o pico de excitação para a absorção de dois fótons é muito semelhante ou com deslocamento para o azul em relação ao perfil de fóton único (Figura 7). As médias mais curtas dos comprimentos de onda podem ser vantajosas ao atrelar a excitação do fluoróforo ao intervalo de comprimento de onda disponível dos lasers com bloqueio de modo. Outro aspecto consistente dos espectros de absorção de dois fótons é que normalmente eles são muito mais amplos do que suas contrapartes de fóton único. Isso diminui as restrições experimentais ao aumentar o intervalo de comprimentos de onda adequados para excitação e aumenta a capacidade de excitar ao mesmo tempo dois fluoróforos que tenham seções de choque de dois fótons sobrepostas, mas espectros de fóton único amplamente distintos. Medições das seções de choque de três fótons indicam que eles são, em geral, muito semelhantes aos espectros correspondentes de fóton único.
Embora os espectros de absorção costumem diferir para excitação com um e dois fótons, outras propriedades de fluorescência, como vida útil, comprimentos de onda de emissão e a taxa de passagem intersistemas não parecem ser afetadas. Essa similaridade indica que os mesmos estados excitados de fluorescência são alcançados por absorção linear ou não linear, e que uma vez que o fluoróforo tenha sido excitado, ele se comportará de maneira igual independentemente do modo de excitação. Esses princípios também são mantidos para a excitação de três fótons, permitindo que os investigadores utilizem métodos raciométricos e espectroscópicos bem estabelecidos em vários experimentos multifotônicos.
Danos por luz e calor na excitação multifotônica
Todas as formas de microscopia de fluorescência sofrem com fotodanos a células vivas. O grau desses danos depende do comprimento de onda da excitação, duração da exposição e natureza química dos fluoróforos utilizados como sondas celulares. O dano induzido pela iluminação de excitação pode ser separado em duas categorias: dano térmico e degradação decorrente de reações químicas. Os efeitos colaterais fotoquímicos causados por reações bioquímicas, como um resultado da excitação do fluoróforo, não são bem entendidos e variam muito entre os tipos de células e tecidos. Por outro lado, o dano por calor surge principalmente de dois mecanismos que ocorrem por causa da absorção de um só fóton pela água e por absorção de dois fótons dos fluoróforos na região focal.
Na maioria das células estudadas (particularmente em células de mamíferos), praticamente não há absorção de radiação de excitação de comprimento de onda longo no intervalo de infravermelho próximo por fluoróforos intrínsecos utilizados em fluorescência multifotônica. No entanto, a água intra e intercelular que permeia as células e tecidos adjacentes pode absorver quantidades significativas de iluminação no intervalo infravermelho e infravermelho próximo, produzindo calor excessivo e potencialmente danoso à viabilidade de espécimes biológicos. Por outro lado, quando o ambiente biológico aquoso é iluminado com os comprimentos de onda ultravioleta e visíveis mais curtos utilizados na microscopia de fluorescência confocal e de campo amplo, não há a absorção de uma quantidade significativa de calor pela água circundante.
O aquecimento decorrente da absorção de fóton único pela água ocorre por todo o caminho do feixe, tanto acima quanto abaixo do plano focal. Sob condições multifotônicas médias controladas, calculou-se que o aumento de temperatura induzido varia de 0,065 a 1,1 graus centígrados a 700 e 1.000 nm, respectivamente. Esses cálculos corroboram as medições de calor realizadas a 1.064 nm com excitação por laser com pinça óptica. Em situações nas quais o feixe de luz excitante é mantido imóvel, o aquecimento pode ser maior, aumentando rapidamente seguindo uma relação logarítmica com o tempo. O aquecimento decorrente da absorção de fluoróforos é altamente localizado na região focal em experimentos de excitação multifotônica. A liberação subsequente de calor ocorre de maneira uniforme em uma região esfericamente simétrica ao redor do volume focal, sem produzir quantidades significativas de calor mesmo diante de altas concentrações de fluoróforos.
Conclusões
A microscopia de fluorescência multifotônica está conquistando seu lugar como um dos métodos preferenciais para a formação dinâmica de imagens de células e tecidos de animais experimentais vivos. A técnica é particularmente útil para observar a dinâmica de células localizadas de maneira profunda na amostra. Além disso, efeitos colaterais como fotobranqueamento e fotodano são minimizados na excitação multifotônica e só ocorrem na região imediatamente ao redor do volume focal.
A fototoxicidade nas células em um fenômeno pouco entendido, mas ocorre em grande escala na maioria das formas de microscopia de fluorescência. A energia quântica baixa e a baixa absorção intrínseca dos comprimentos de onda mais longos utilizados na microscopia multifotônica servem para reduzir os efeitos deletérios da luz sobre as células e tecidos vivos, abrindo a porta para investigações sobre a dinâmica celular. O alto custo do equipamento representa um grande obstáculo para a pesquisa na área de microscopia multifotônica, em especial o preço dos sistemas de laser pulsado com bloqueio de modo, que são necessários para a excitação com dois e três fótons. Em geral, os sistemas de laser ultrarrápido mais populares usam lasers de titânio/safira. A capacidade de ajuste de comprimento de onda do laser pulsado de titânio/safira (700 a 1.300 nm) faz com que ele seja muito mais versátil. Essa disponibilidade representará um incentivo para a disseminação do uso dessa técnica nas ciências biológicas.
Sorry, this page is not
available in your country.



