Einblick in die Regulierungsmechanismen für den korrekten Zusammenbau motiler Multizilien mithilfe von Hochgeschwindigkeitsaufnahmen in Lebendzellen
In diesem Anwendungsbeispiel geht es um die Untersuchung der Bildung, Bewegung und Zusammensetzung von Zilien. Sie erfahren, wie mithilfe der Hochgeschwindigkeitsbildgebung in Lebendzellen Regulierungsmechanismen für den korrekten Zusammenbau motiler Multizilien charakterisiert werden.
Was sind Zilien und welche Funktion haben sie?
Zilien sind haarähnliche Strukturen, die in tierischen Zellen eine Vielzahl von wichtigen Funktionen erfüllen. Zu diesen Funktionen gehören die Fortbewegung, die Wahrnehmung der Umgebung und die Nahrungsaufnahme. Zilien haben einen Durchmesser von etwa 0,2 μm und sind 10 μm lang.
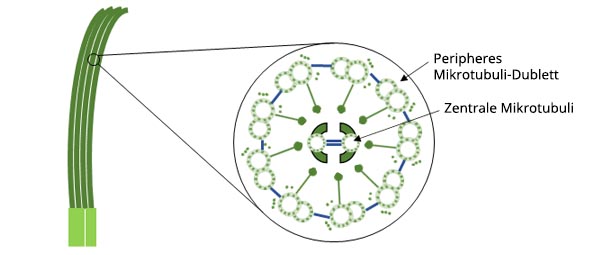
Abbildung 1: Schematische Darstellung des Aufbaus von Zilien.
Zilien können auch der Fortbewegung einer Zelle dienen. Beispielsweise sind Paramecien – mikroskopisch kleine Organismen in Teichen und Flüssen – mit Zilien bedeckt, die wie kleine Ruder die Paramecien durch das Wasser bewegen.
Bei größeren Tieren übernehmen Zilien komplexere Funktionen. Sie erzeugen den Antrieb für die Bewegung, damit beispielsweise Spermien und Eizellen miteinander verschmelzen. Einige Zilien fungieren als Antennen, die Reize von außen wahrnehmen.
Die meisten tierischen Zellen, d. h. auch fast alle Arten von Zellen im menschlichen Körper, haben Zilien auf der Oberfläche. Es gibt motile und nicht-motile Zilien; die meisten motilen Zilien kommen als Cluster vor. Multizilierte Zellen (Multiciliated Cells, MCCs) sind Epithelzellen mit Hunderten von motilen Zilien, die dazu dienen, Flüssigkeit über die Oberfläche der Zelle zu bewegen. Sie sind vor allem in Epithelgeweben zu finden, dünnem Gewebe auf verschiedenen Körperoberflächen und in Auskleidungen von Körperhöhlen. In den Atemwegen reinigen und befreien MCCs den Körper von Schleim und anderen Reizstoffen. Im Rückenmark und in den Hirnventrikeln von Erwachsenen transportieren sie Liquor durch das zentrale Nervensystem.
Wenn Zilien nicht richtig funktionieren, kann dies zahlreiche Auswirkungen auf die menschliche Gesundheit haben. Genetische Erkrankungen beim Menschen, die eine Anomalie der Zilien verursachen, werden als Ziliopathien bezeichnet. Die Liste der Ziliopathien wird immer länger und umfasst eine Reihe von seltenen Krankheiten, die oft mehrere Organe im Körper betreffen. Wenn die Forscher mehr darüber wissen, wie sich Zilien bilden, bewegen und zusammensetzen, können sie diese Krankheiten besser verstehen.
Die Beziehung zwischen Zentriolen und Zilien
Zentriolen sind zylinderförmige Strukturen, die für die Bildung sowohl von Zilien als auch von Zentrosomen unerlässlich sind. In Zellen treten Zentriolen in der Regel paarweise auf. Bestimmte Proteine können sich um jedes Zentriolenpaar versammeln und Zentrosomen bilden. Zentrosomen sind Organellen, die für das Wachstum und die Verankerung von Mikrotubuli in der Zelle verantwortlich sind. Sie spielen eine wichtige Rolle bei der Organisation der Mikrotubuli in der Zelle und regulieren die Zellteilung.
Wenn Zellen ihre Chromosomen vor der Teilung verdoppeln, teilen sich die beiden Zentriolen zu zwei Tochter-Zentriolen in den beiden Zellhälften, um zwei Zentrosomen zu bilden. Diese beiden Zentrosomen, die aus einem Mutter-Tochter-Zentriolenpaar und den sie umgebenden radialen Mikrotubuli bestehen, bilden dann die Spindelpole, die für die gleichmäßige Verteilung des genetischen Materials (Chromosomen) auf die beiden Tochterzellen verantwortlich sind. Nach der Teilung verfügt jede Tochterzelle über die gleiche Anzahl von Chromosomen und ein Zentrosom.
In der nichtproliferativen Phase der Zelle ist das Mutter-Zentriol an der Zellmembran verankert, und an seiner Spitze bilden sich Zilien. Kurz vor der Vermehrung der Zelle verkürzen sich die Zilien nach und nach und verschwinden vor der Zellteilung vollständig. Dadurch wandern die Zentrosomen in das Zytoplasma und bilden Spindeln. Somit hat das Zentriol zwei verschiedene Funktionen bei der Bildung von Zentrosomen und Zilien.
Warum entstehen spontan mehrere neue Zentriolen?
Wenn sich Zentriolen nur einmal pro Zellzyklus duplizieren, woher kommt dann die große Anzahl von Zentriolen in MCCs (z. B. die Zilien bei Paramecien)? Bereits in den 1960er Jahren beobachteten Zellbiologen mithilfe der Elektronenmikroskopie, dass sich Zentriolen bei der Bildung von MCCs schnell ausdehnen. Außerdem wurde unerwartet festgestellt, dass sich mehr Zentriolen um viele kreisförmige Strukturen, so genannte Deuterosomen, bildeten.
Jahrzehnte später ist immer noch wenig darüber bekannt, warum um Deuterosomen herum spontan neue Zentriolen entstehen. Erst eine Studie unseres Labors aus dem Jahr 2013 brachte Licht ins Dunkel.1 Wir fanden heraus, dass ein Paar homologer Proteine, Deup1 und Cep63, in höheren Tieren die beiden Zentriolen-Amplifikationsmodi der De-novo-Bildung (d. h. des Zusammenbaus von Zentriolen ohne vorher existierende Zentriole) bzw. der Mutter-Zentriolen-abhängigen Bildung bei der Entstehung multipler Zilien reguliert. Dadurch wurde klar, woher die vielen neuen Zentriolen in MCCs kommen.
Der präzise Zusammenbau motiler Zilien
Motile Zilien enthalten Hunderte von Proteinkomponenten, die während der Differenzierung der multizilierten Zellen in großen Mengen synthetisiert werden. Eine weitere wichtige und unbeantwortete wissenschaftliche Frage ist, ob sie sich spontan zusammenfinden oder auf eine bestimmte Art und Weise organisiert und bei Bedarf gespeichert werden.
Unsere veröffentlichten Ergebnisse zeigen, dass fibrogranuläre Materialien (FGMs) – eine subzelluläre Struktur, die nur in MCCs vorkommt – eine wichtige Rolle als Organisatoren bei der Regulierung des präzisen Zusammenbaus motiler Zilien spielen.2
Faserige Granula sind subzelluläre Strukturen, die nur in höheren tierischen MCCs vorkommen. Obwohl sie bereits in den 1960er Jahren in Untersuchungen mit dem Elektronenmikroskop entdeckt wurden, weiß man über ihre Zusammensetzung und Funktion bisher nur, dass sie das Perizentrosom-Matrixprotein (PCM1) enthalten. Durch Kombination von Proteomik, super auflösender Mikroskopie, Hochgeschwindigkeitsmikroskopie von Lebendzellen und mehreren Elektronenmikroskopie-Techniken haben wir Folgendes herausgefunden:
- Faserige Granula sind große, flüssigkeitsähnliche, membranlose Organellen, die durch PCM1-Phasentrennung entstehen, an Deuterosomen haften und ihre maulbeerartige Struktur mit vielen Strukturproteinen des spezifischen Stromas und der Zilien anreichern. Diese Strukturproteine sind in verschiedenen Stadien der Zilienbildung in der Matrix und den Zilien lokalisiert.
- Die künstliche Senkung des PCM1-Proteinspiegels verhindert, dass MCCs faserige Partikel bilden, und führt zu einer abnormalen Anzahl, Größe und Verteilung von Deuterosomen. Obwohl diese Zellen schließlich die gleiche Anzahl von Zilien bildeten wie die Kontrollzellen, war die Struktur dieser Zilien und ihrer Matrix erheblich gestört. Dies führte zu schwerwiegenden Anomalien in der Motilität der Zilien und in der Art und Weise, wie die Zilien sich hin- und herbewegen.
- Eine detaillierte Analyse ergab, dass die in den faserigen Partikeln angereicherten Komponenten bereits im Vorfeld in der Matrix lokalisiert waren und die Struktur der zentralen Mikrotubuli-Basis der Zilien deutlich erweitert war. Dies deutet darauf hin, dass die chronologische Reihenfolge ihres Zusammenbaus gestört ist, was sich auf die Genauigkeit und Funktion der Struktur motiler Zilien auswirkt.
Daher fungieren faserige Granula während der Differenzierung von MCCs als Organisator. Sie dienen als Lagerplatz für Zilienkomponenten, haften am Deuterosom und ordnen sich in der Nähe der Basis der neuen Zilien an, um den ordnungsgemäßen Zusammenbau der Feinstruktur motiler Zilien zu gewährleisten.
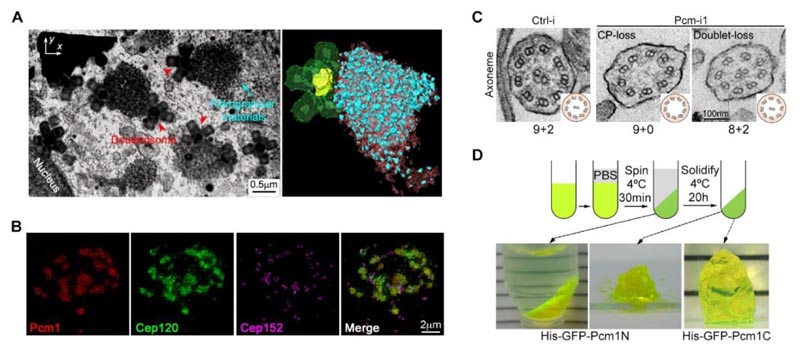
Abbildung 2: (A) Die Fokus-Ionenstrahl-Rasterelektronenmikroskopie (FIB-SEM) zeigt die räumliche Verteilung von faserigen Partikeln und Deuterosomen in multizilierten Zellen. (B) Die faserige Partikelstruktur kann das Strukturprotein Cep120 in der Matrix anreichern. (C) Die Senkung des PCM1-Proteinspiegels führt zu deutlichen Defekten in der Ultrastruktur der motilen Zilien. (D) PCM1-Fragmente haben die Eigenschaft der Phasentrennung2
Analyse des korrekten Zusammenbaus motiler Multizilien
In unserem Forschungsprojekt2 haben wir eine Reihe von Bildgebungstechnologien eingesetzt, darunter superauflösende Mikroskopie, Hochgeschwindigkeitsmikroskopie mit Lebendzellen und Elektronenmikroskopie. Im Mittelpunkt dieser Arbeit stand das superauflösende IXplore SpinSR Mikroskop von Evident. Im Folgenden erläutern wir detailliert, wie wir das IXplore SpinSR System in unserer Forschung eingesetzt haben.
Wir führten eine Zwei-Kanal-Lebendzell-Bildgebung von ventrikulären ependymalen Epithelzellen (mEPCs) der Maus durch, die mit Adenovirus und Lentivirus infiziert waren, um SNAP-Deup1 unter GFP-PCM1- und Deup1-Promotoren zu exprimieren.
Wir beobachteten das dynamische Verhalten von GFP-PCM1 in mEPCs mithilfe der In-vivo-Live-Bildgebung mit dem IXplore SpinSR System. Da die Expression von SNAP-Deup1 vom Deup1-Promotor gesteuert wird, zeigt das Auftreten von SNAP-Deup1-positiven Signalen an, dass in der Zelle eine Zentriolenexpansion stattfindet.
In der Bildgebung war Folgendes zu erkennen:
- Es gab eine klare Kolokalisierung zwischen SNAP-Deup1-markierten Deuterosomen und GFP-PCM1-markierten FGMs in mEPCs. Sie sind unterschiedlich groß, bewegen sich aber aufeinander zu.
- Die größeren FGM-Punkte scheinen das Deuterosom vollständig zu umschließen, und manchmal sind mehrere Deuterosomen auf einen großen FGM-Punkt beschränkt.
- Wenn zwei FGM-Punkte aufeinandertreffen, verschmelzen sie allmählich zu einem größeren FGM-Punkt, wobei ihre inneren Deuterosomen miteinander verschmolzen sind (Abbildung 3). Diese Experimente haben also bewiesen, dass FGMs Eigenschaften einer Flüssigkeit aufweisen und fest an Deuterosomen binden.
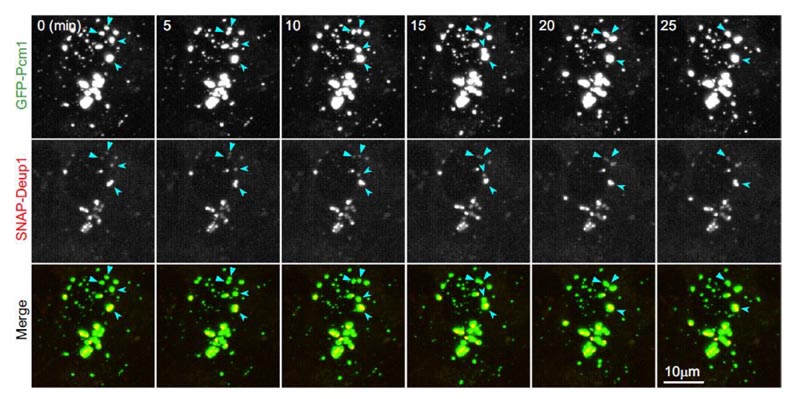
Abbildung 3: FGMs in lebenden mEPCs haben Eigenschaften einer Flüssigkeit und binden fest an das Deuterosom. Der FGM-Punkt hat Eigenschaften einer Flüssigkeit und bindet an das Deuterosom. An Tag 3 wurden alle fünf Minuten Live-Bilder von mEPCs erstellt. GFP-PCM1 und SNAP-Deup1 bezeichnen FGMs bzw. Deuterosomen. Die Pfeile deuten auf das Fusionsereignis der beiden FGMs in der Bildsequenz.2
Bildgebungsbedingungen
System: IXplore SpinSR System (konfokaler Modus)
Objektiv: APON60XOTIRF/ 1,49 NA
Belichtungszeit: 100 Millisekunden
Dauer: Alle fünf Minuten über 65 Minuten
Außerdem inkubierten wir in Transwells gezüchtete tracheale Epithelzellen der Maus (MTECs) mit 200 nM SiR-Tubulin, um ihre Multizilien fluoreszierend zu markieren. Durch Verwendung der Hochgeschwindigkeitsbildgebung auf dem IXplore SpinSR System zur Erfassung motorischer Trajektorien von GFP-Centrin1-positiven MTECs fanden wir heraus, dass die motilen Zilien in den Kontrollzellen meist eine regelmäßige, wellenförmige Bewegung aufwiesen, während die motilen Zilien in den PCM1-depletierten MTECs unregelmäßig rotierten oder ihre Bewegungsfähigkeit komplett verloren hatten (Abbildung 4).
Related Videos

Abbildung 4: Die Deletion von PCM1 führt zu abnormer ziliärer Motilität von MTECs.2
Bildgebungsbedingungen
System: IXplore SpinSR System (superauflösender Modus)
Objektiv: APON60XOTIRF (1,49 NA)
Belichtungszeit: 14 Millisekunden
Aufnahmezeit: 15-Millisekunden-Intervall, 3 Sekunden
Wie das IXplore SpinSR Mikroskopsystem mit Superauflösung das Experiment erleichterte
Das IXplore SpinSR Mikroskopsystem mit Superauflösung ermöglicht die Live-Beobachtung von Präparaten. Es nutzt die konfokale Spinning-Disk-Technologie für eine schnelle Bildaufnahme mit minimaler Phototoxizität für Lebendzellen.
Die Zeitrafferbeobachtung ist ein gängiges Instrument in der biologischen Forschung, um Veränderungen in intrazellulären Strukturen und Phänomenen zu erfassen. Sie erfordert jedoch Einstellungen, die auf die für die Erfassung dieser Veränderungen erforderlichen Beobachtungsbedingungen zugeschnitten sind. Das IXplore SpinSR System ermöglicht die superauflösende Bildgebung von Lebendzellen, um schnelle Veränderungen und die richtigen Phänomene zu erfassen. Dazu wird die Phototoxizität so weit wie möglich minimiert.
Neben den leistungsstarken Funktionen der Hardware ermöglicht die Hochgeschwindigkeitsdatenverarbeitung des IXplore SpinSR Systems die Anzeige von superaufgelösten Bildern in einem Live-Display-Fenster.
Hauptmerkmale:
- Horizontale Auflösung: 110 nm (SoRa-Scheibenkombination)
- Hochgeschwindigkeitsscannen
- Mehrfarbige superauflösende Bildgebung
- Problemlose Konfiguration
| DanksagungenDieser Artikel wurde gemeinsam mit Yan Xiumin, Shanghai Institute of Biochemical Cell Biology, Chinese Academy of Sciences, verfasst. |
Literaturnachweis
1. Huijie Zhao et al. „The Cep63 paralogue Deup1 enables massive de novo centriole biogenesis for vertebrate multiciliogenesis.“ Nature Cell Biology, Nr. 15 (Dec. 2013): 1434–1444. doi: 10.1038/ncb2880.
2. Huijie Zhao et. al. „Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly.“ Nature Communications, Nr. 12: 1273 (Feb. 2021). doi.org/10.1038/s41467-021-21506-8.
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
