IXplore SpinSRを用いた運動性繊毛の制御機構解明
繊毛は真核生物に存在する細胞小器官であり、直径は0.2μmで、長さは数マイクロメートルの短いものから数十マイクロメートル以上の長いものまで様々存在します。繊毛は、細胞の遊泳に必要な推進力を生みだすものですが、生物の進化と共に繊毛に頼らずとも体を動かすことができるようになり、より複雑な機能を持つようになりました。運動するための原動力となるだけでなく、外部の刺激を感知する「触覚」として適応したものもあります。
繊毛は多くの動物細胞の表面に存在し、運動性繊毛と非運動性繊毛に分けられます。多繊毛細胞の運動性繊毛は、細胞内や細胞間で協調して運動しており、高等動物では主に気管・脳室・卵管において、繊毛の周期的振動により気管を潤し浄化したり、脳脊髄液の流れや受精卵の輸送を駆動しています。この繊毛の動きが不調になると、人間の健康に様々な影響を及ぼします。
今回の実験では、IXploreSpinSRを用いたライブ超解像観察による特定タンパク質の動的挙動観察により、繊毛の運動異常の機構を解明しました。
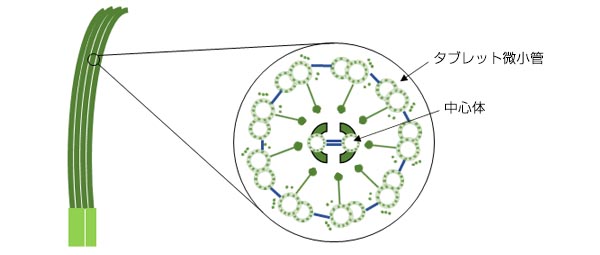
図1. 繊毛構造の模式図
1. 中心体と繊毛の関係
繊毛の構造体を形成するには中心体が必要となります。中心小体が細胞膜に連結して「基底小体」と呼ばれる構造になり、そこから繊毛が生えてくることが観察されています。中心体は中心小体が2つ組み合わさって形成されています。一方が母中心小体でもう一方が娘中心小体です。
中心体形成が1対1であることを考えると、多繊毛類の大量の中心体はどこから来るのでしょうか。1960年代には多繊毛細胞の形成中の中心小体の増殖が電子顕微鏡を用いて観察されていました。このとき、母中心小体が娘中心小体を多数生み出すことができ、さらに「基底小体前駆体(deuterosome)」と呼ばれる円形構造の周りに多くの中心小体が形成されることが実際に発見されていました。しかし、その多数の中心小体がどこから現れるのかは解明されていませんでした。その後、Deup1とCep63というタンパク質がそれぞれ多繊毛化の過程で中心小体の増幅を制御するという、多繊毛細胞における大量の中心小体の起源が明らかにされました。[Zhao et al., Nat Cell Biol, 2013, 15(12):1434-44]
2. 繊毛の緻密な組み立て機構
繊毛には何百ものタンパク質成分が含まれており、多繊毛細胞の分化過程で大量に合成されますが、どのようにして正確に組み立てられているのかは詳細には解明されていませんでした。繊維状粒状物質(fibrogranular materials, FGMs)は高等動物の多繊毛細胞にのみ存在する細胞内構造物であり、1960年代に電子顕微鏡による研究で同定されましたが、中心体マトリクス(Pcm1)を含んでいるという知見を除いては、その組成や機能は未だ不明でした。Xiumin Yan教授らの研究により、多繊毛細胞のユニークな細胞構造物であるFGMが、運動性繊毛の精密な組み立てを制御する重要な役割を担っていることが明らかになりました。[Zhao&Chen et al. Nat Commun, 2021, 12(1):1273]
3. IXploreSpinSRによる多繊毛細胞の正常な組み立て機構のイメージング
マウス脳室上衣細胞(Mouse ependymal cell : mEPC)にDeuplプロモーター下でGFP-Pcm1およびSNAP-Deup1を発現させ、IXploreSpinSRを使用して2チャンネルのイメージングを行いました。このイメージングにより、マウス脳室上衣細胞におけるGFP-Pcm1の挙動を観察することができました。SNAP-Deup1の発現はDeup1プロモーターによって制御されているため、SNAP-Deup1陽性のドットは、細胞が中心小体の増殖を起こしていることを示しました。
イメージングにより、次の3点がわかりました。
- マウス脳室上衣細胞においてSNAP-Deup1ラベルの基底小体前駆体とGFP-Pcm1ラベルのFGMが有意に共局在していることが確認されました。
- 大きなサイズのFGMのドットは基底小体前駆体を完全に包みこむように見えます。時には一つの大きなサイズのFGMのドットの中に複数の基底小体前駆体が閉じ込められていました。
- 2つのFGMのドットが近づくと徐々に融合して、一つのFGMドットになり、その時点で内部の基底小体前駆体も融合していました。
このように長時間の安定した観察且つ高解像でのイメージングによりFGMが液体的な性質を持ち、基底小体前駆体に結合していることを経時的に観察することができました。(図2)
![図2. FGM部分が液体特性を持ち、基底小体前駆体に結合している様子を5分間隔で合計65分間撮影しました。矢印は2つのFGMの融合を示しています。[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]](https://static1.olympus-lifescience.com/data/Image/Application/revealing-the-regulatory-mechanisms/appnote_revealing-the-regulatory-mechanisms_03.jpg?rev=AEC1)
図2. FGM部分が液体特性を持ち、基底小体前駆体に結合している様子を5分間隔で合計65分間撮影しました。矢印は2つのFGMの融合を示しています。[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]
撮影条件
システム:IXploreSpinSR(共焦点モード)
対物レンズ:APON60XOTIRF/1.49 NA
露出:100msec
撮影時間:5分間隔、65分間
また、マウス気管上皮細胞(mTECs)においては、マウス気管上皮細胞の運動性繊毛の動く様子を15msec間隔で3秒間、IXplore SpinSRで高速超解像イメージング撮影をしました。コントロールの細胞(shCtrl-i)では運動性繊毛は規則正しい振動を示しましたが、Pcm1ノックダウンの細胞(shPcm-i1)では不規則に回転するか完全に運動性が失われていました(動画1)。IXploreSpinSRでライブ超解像撮影することにより、繊毛の高速な動きが解像よくリアルタイムに捉えることができました。
また、繊毛運動のカイモグラフを作成したところ、Pcm1の欠損はマウス気管上皮細胞の繊毛運動異常をもたらすことが観察されました。(図3)
Related Videos
動画1. 画面左shCtrl-i、画面右shPcm-i1
![図3. Pcm1欠損マウス気管上皮細胞(mTEC)の繊毛運動。2本の直行する箇所(矢印で示した細胞)をカイモグラフ表示しました。[Zhao & Chen et al., Nat Commun, 2021,12(1):1273]](https://static4.olympus-lifescience.com/data/Image/Application/revealing-the-regulatory-mechanisms/appnote_revealing-the-regulatory-mechanisms_04.jpg?rev=AEC1)
図3. Pcm1欠損マウス気管上皮細胞(mTEC)の繊毛運動。2本の直行する箇所(矢印で示した細胞)をカイモグラフ表示しました。[Zhao & Chen et al., Nat Commun, 2021,12(1):1273]
撮影条件
システム:IXploreSpinSR(超解像モード)
対物レンズ:APON60XOTIRF/1.49 NA
露出時間:14msec
撮影時間:15msec間隔、3秒間
これらの高速ライブセルイメージングや超解像イメージング、その他プロテオミクス解析等の様々な技術を組み合わせる事で、以下の事が明らかになりました。
- FGMは、Pcm1の相分離により形成された、大型(直径2μm程度)で動的な膜のない液体特性を持つオルガネラでした。基底小体前駆体に付着するだけでなく、その構造の中に繊毛特有の構造タンパク質等が大量に含まれていました。
- Pcm1タンパク質をノックダウンすると、多繊毛細胞がFGMを形成しなくなるだけでなく、基底小体前駆体の数・サイズ・分布に異常が見られました。これらの細胞は最終的には、コントロールの細胞と変わらない数の繊毛を形成しましたが、繊毛と基底体の微細構造は著しく欠陥があり、繊毛がくねくねと動く様子と能力に重大な異常が生じました。(図4c)
- FGMが豊富に含まれる場合、繊毛の中心微小管の基部構造が著しく伸長していることから、繊毛の組み立て順序が崩れ、運動繊毛構造の精度と機能に影響を与えていることが示唆されました。
![図4. (A)走査電子顕微鏡(FIB-SEM)による多繊毛細胞におけるFGMと基底小体前駆体の空間分布観察;(B)FGMはマトリックスの構造タンパク質Cep120を濃縮;(C)Pcm1のタンパク質をノックダウンすることにより運動性繊毛の超微細構造に欠陥が生じました;(D)Pmc1断片には相分離性がありました[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]](https://static3.olympus-lifescience.com/data/Image/Application/revealing-the-regulatory-mechanisms/appnote_revealing-the-regulatory-mechanisms_02.jpg?rev=85EC)
図4. (A)走査電子顕微鏡(FIB-SEM)による多繊毛細胞におけるFGMと基底小体前駆体の空間分布観察;(B)FGMはマトリックスの構造タンパク質Cep120を濃縮;(C)Pcm1のタンパク質をノックダウンすることにより運動性繊毛の超微細構造に欠陥が生じました;(D)Pmc1断片には相分離性がありました[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]
このようにFGMは多繊毛細胞の分化において、運動性繊毛の微細構造を正しく組み立てる機能を発揮しています。
その現象をIXploreSpinSRでの超解像ライブセルイメージングにより、FGMの動態を経時的かつ高解像に観察することができ、繊毛運動の微細かつ高速な動きを捉えることで解明することができました。
実験を可能にしたIXplore SpinSRの技術
IXplore SpinSRは、標本のライブ観察を実現した超解像イメージングシステムです。スピニングディスク共焦点光学系を採用し、生細胞への光毒性を抑えたスピーディーな画像取得を実現します。
細胞内構造や現象の変化を捉えることのできるタイムラプス観察は、生物学研究では一般的なツールですが、その変化を捉えるための観察条件に合わせて設定をする必要があります。IXplore SpinSRはライブセル超解像イメージングを実現し、高速な変化を捉えるだけでなく、できるかぎり光毒性を抑えることで正しい現象を捉えることが可能です。
ハードウェア性能に加え、独自の高速超解像処理によって超解像のライブディスプレイを実現します。
主な特徴
- 水平分解能110nm (Soraディスク組み合わせ)
- 高速スキャン
- マルチカラー超解像イメージング
- 簡単設定
| 謝辞本アプリケーションノートは中国科学院上海生化学細胞生物学研究所Xiumin Yan先生のご協力を得て作成されました。 |
参考文献
1.Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly
NATURE COMMUNICATIONS | (2021) 12:1273 | https://doi.org/10.1038/s41467-021-21506-8 | www.nature.com/naturecommunications
Huijie Zhao 1,2,7, Qingxia Chen1,3,7, Fan Li1,2, Lihong Cui4, Lele Xie1, Qiongping Huang1, Xin Liang 4,Jun Zhou 5, Xiumin Yan1 & Xueliang Zhu
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。
