Revelação dos mecanismos reguladores para a montagem adequada de multicílios móveis usando formação de imagem de células vivas em alta velocidade
Esta nota da aplicação apresenta os cílios e explora como eles se formam, se movem e se montam. Saiba como a pesquisa com o uso de formação de imagem de células vivas em alta velocidade está revelando os mecanismos reguladores para a montagem adequada de multicílios móveis.
Introdução aos cílios
Cílios são estruturas semelhantes a pelos que servem para uma grande variedade de funções essenciais nas células de animais. Estas funções incluem locomoção, sensibilidade do ambiente e alimentação. Os cílios têm cerca de 0,2 μm de diâmetro e 10 μm de comprimento.
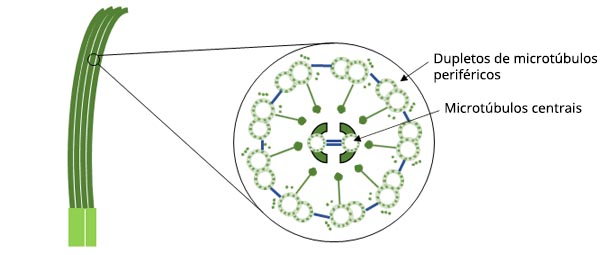
Figura 1. Diagrama esquemático da estrutura dos cílios.
Na locomoção, os cílios servem como remos que movem a célula. As Paramécias, organismos microscópicos que habitam em lagoas e riachos, são cobertas por cílios que batem como remos em miniatura para impulsionar as criaturas através da água.
Em animais maiores, os cílios assumem funções mais complexas. Eles fornecem uma fonte de energia para o movimento, como conduzir o espermatozoide até o ovócito para a união. Alguns cílios funcionam como antenas para sentir os estímulos externos.
A maioria das células animais, incluindo quase todos os tipos de células no corpo humano, têm cílios na sua superfície. Os cílios se dividem em cílios móveis e cílios estáticos, e a maioria dos cílios móveis existe em aglomerados. As células multiciliadas (MCCs, na sigla em inglês) são células epiteliais que contêm centenas de cílios móveis usados para impulsionar fluidos para a superfície da célula. Elas estão distribuídas principalmente nos tecidos epiteliais – tecidos finos que cobrem várias superfícies e revestimentos em todo o corpo humano. No trato respiratório, as MCCs limpam e removem muco e outros agentes irritantes do corpo. Na medula espinhal e nos ventrículos cerebrais de adultos, elas movem o líquido cefalorraquidiano através do sistema nervoso central.
Quando os cílios não funcionam adequadamente, podem causar uma grande variedade de efeitos na saúde humana. As doenças genéticas que causam anormalidades nos cílios humanos são coletivamente chamadas de ciliopatias. A lista de ciliopatias continua a crescer com uma variedade de doenças raras que geralmente afetam vários órgãos do corpo. Entender mais sobre como os cílios se formam, se movem e se montam pode ajudar os pesquisadores a saber mais sobre essas doenças.
A relação entre centríolos e cílios
Centríolos são estruturas em formato cilíndrico que são essenciais para a formação dos cílios e dos centrossomas. Nas células, os centríolos geralmente aparecem em pares. Algumas proteínas específicas podem se reunir em torno de cada par de centríolos para formar os centrossomas, organelas responsáveis pelo crescimento e ancoragem dos microtúbulos nas células. Os centrossomas atuam como os principais centros organizadores de microtúbulos da célula e reguladores da divisão celular.
À medida que as células copiam seus cromossomos antes da divisão, os dois centríolos se separam para que um centríolo-filho cresça de cada lado para formar dois centrossomas. Em seguida, esses dois centrossomas, compostos por um par de centríolos mãe e filho e pelos microtúbulos radiais em torno deles, formam os polos do fuso que são responsáveis pela distribuição igualitária do material genético (cromossomos) pelas duas células-filha. Após a divisão, cada célula-filha adquire o mesmo número de cromossomos e um centrossomo.
Quando as células estão na fase de não proliferação, o centríolo-mãe é ancorado na membrana celular e os cílios crescem em sua ponta. Quando a célula está prestes a se proliferar, os cílios se encurtam gradativamente e desaparecem por completo antes da divisão celular. Isso permite que os centrossomas sejam liberados no citoplasma para formar fusos. Desta maneira, o centríolo exerce dois papéis diferentes para formar centrossomas e cílios.
Entender por que vários novos centríolos aparecem espontaneamente
Já que os centríolos se duplicam uma vez por ciclo celular, de onde vêm os grandes números de centríolos nas MCCs (como nos cílios e nas Paramécias)? Já na década de 60 os biólogos celulares usavam a microscopia eletrônica para observar os centríolos se expandindo rapidamente durante a formação das MCCs. Eles também descobriram inesperadamente que mais centríolos se formavam em torno de várias estruturas circulares chamadas deuterossomos.
Décadas mais tarde, pouco se sabia sobre o por que de novos centríolos aparecerem espontaneamente em torno dos deuterossomos. Até que em 2013, um estudo feito no nosso laboratório desvendou o mistério.1 Descobrimos que um par de proteínas homólogas, a Deup1 e a Cep63, em animais superiores, regulava os dois modos de amplificação do centríolo da formação "de novo" (ou seja, montagem de centríolos sem nenhum centríolo preexistente) e da formação dependente do centríolo-mãe no processo de produção de cílios múltiplos, respectivamente. Isto esclareceu a origem de vários novos centríolos nas MCCs.
A montagem precisa dos cílios móveis
Os cílios móveis contêm centenas de componentes proteicos que são sintetizados em grandes quantidades durante a diferenciação das células multiciliadas. Se eles são uma montagem espontânea ou são organizados de uma forma específica e armazenados sob demanda, é outra pergunta científica importante não respondida.
Nossas descobertas publicadas revelam que materiais fibrogranulares (FGMs, na sigla em inglês), uma estrutura subcelular exclusiva das MCCs, exercem um importante papel como organizadores na regulação da montagem precisa dos cílios móveis.2
Grânulos fibrosos são estruturas subcelulares presentes apenas nas MCCs de animais superiores. Embora tenham sido descobertos em estudos de microscopia eletrônica na década de 60, sua composição e função ainda não foram esclarecidas, exceto o conhecimento de que eles contêm a proteína da matriz pericentriolar (PCM1). Combinando proteômica, microscopia de super-resolução, microscopia em alta velocidade de células vivas e várias técnicas de microscopia eletrônica, descobrimos que:
- Os grânulos fibrosos são organelas grandes sem membrana e com características líquidas, formados pela separação de fase da PCM1, que se aderem aos deuterossomos e enriquecem a sua estrutura em forma de amora com várias proteínas estruturais de estroma e cílios específicos. Essas proteínas estruturais localizam-se dentro da matriz e dos cílios em diferentes estágios da ciliogênese.
- Inativar artificialmente o nível de proteína da PCM1 evita que as MCCs formem partículas fibrosas e leva ao número, tamanho e distribuição anormais do deuterossomo. Embora essas células eventualmente formassem o mesmo número de cílios que as células de controle, a estrutura dos seus cílios e da matriz era significativamente defeituosa. Isso resultava em anormalidades graves na forma como os cílios se movem e na sua capacidade para se mover.
- Uma análise aprofundada revelou que os componentes enriquecidos nas partículas fibrosas foram localizados na matriz com antecedência, e a estrutura da base do microtúbulo central dos cílios foi significativamente estendida. Isso indicou que a ordem cronológica da montagem foi interrompida, afetando a precisão e a função da estrutura dos cílios móveis.
Portanto, os grânulos fibrosos exercem a função de um organizador durante a diferenciação das MCCs, tanto como depósito de componentes relacionados aos cílios quanto para aderir ao deuterossomo e enriquecer próximo à base dos novos cílios para garantir a montagem adequada da estrutura fina dos cílios móveis.
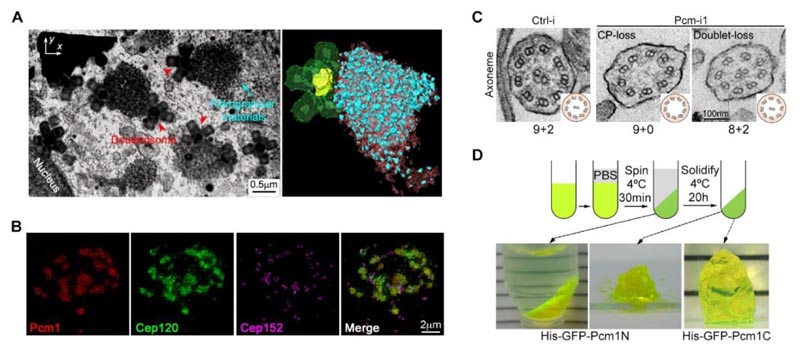
Figura 2. (A) A microscopia eletrônica de escaneamento por feixe de íons focalizados (FIB-SEM) mostrou a distribuição espacial das partículas fibrosas e deuterossomos nas células multiciliadas. (B) A estrutura de partículas fibrosas pode enriquecer a proteína estrutural Cep120 da matriz. (C) Inativar o nível de proteína da PCM1 leva a defeitos óbvios na ultraestrutura dos cílios móveis. (D) Os fragmentos da PCM1 têm a propriedade da separação de fase.2
Análise da montagem adequada dos multicílios móveis
Em nossa pesquisa,2 usamos uma variedade de tecnologias de formação de imagem, incluindo microscopia de super-resolução, microscopia em alta velocidade de células vivas e microscopia eletrônica. O microscópio de super-resolução IXplore™ SpinSR da Evident foi fundamental para este trabalho. Veja a seguir uma apresentação detalhada da aplicação prática do sistema IXplore SpinSR na nossa pesquisa.
Fizemos formação de imagem de dois canais de células vivas de células epiteliais ependimárias (mEPCs, na sigla em inglês) ventriculares de camundongo infectadas com adenovírus e vírus lentivírus para expressar SNAP-Deup1 sob os promotores GFP-PCM1 e Deup1.
Observamos o comportamento dinâmico do GFP-PCM1 nas mEPCs usando imagem em tempo real in vivo no sistema IXplore SpinSR. Como a expressão do SNAP-Deup1 é controlada pelo promotor Deup1, o aparecimento de pontos positivos de SNAP-Deup1 indica que a célula está passando por expansão do centríolo.
Os resultados de imagem mostraram que:
- Houve colocalização clara entre os deuterossomos SNAP-Deup1 marcados e os FGMs GFP-PCM1 marcados nas mEPCs. Eles são de tamanhos diferentes, mas se movem juntos.
- O tamanho maior dos pontos do FGM parece envolver completamente o deuterossomo e, às vezes, vários deuterossomos estão confinados em um grande ponto do FGM.
- Quando dois pontos de FGM se encontram, eles gradualmente se mesclam em um ponto maior de FGMs, onde seus deuterossomos internos se fundem (Figura 3). Portanto, esses experimentos comprovaram que os FGMs têm propriedades líquidas e se vinculam firmemente aos deuterossomos.
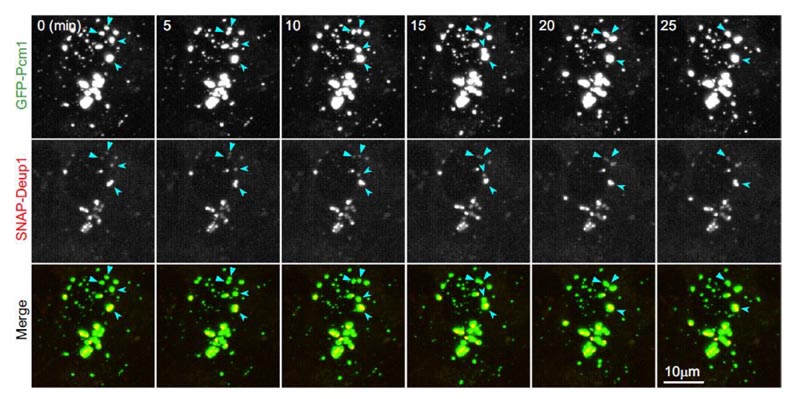
Figura 3. FGMs em mEPCs vivas têm propriedades líquidas e se vinculam firmemente ao deuterossomo. O ponto de FGMs tem propriedades líquidas e se vincula ao deuterossomo. As imagens das mEPCs vivas são projetadas em tempo real a cada cinco minutos no Dia 3. GFP-PCM1 e SNAP-Deup1 indicam FGMs e deuterossomos, respectivamente. As setas indicam o evento de fusão dos dois FGMs na sequência de imagens.2
Condições da formação de imagem
Sistema: IXplore SpinSR (modo confocal)
Lente objetiva: APON60XOTIRF/1,49 AN
Tempo de exposição: 100 milissegundos
Duração: a cada cinco minutos por 65 minutos
Além disso, incubamos células epiteliais traqueais de camundongo (MTECs, na sigla em inglês) cultivadas em Transwells com 200 nM de SiR-tubulina para marcar seus multicílios com fluorescência. Usando formação de imagem em alta velocidade no sistema IXplore SpinSR para capturar as trajetórias motoras das MTECs positivas para GFP-Centrin1, descobrimos que os cílios móveis apresentavam principalmente um balanço regular em forma de onda nas células de controle, enquanto os cílios móveis nas MTECs com PCM1 inativada giravam de forma irregular ou perderam totalmente sua capacidade de se mover (Figura 4).
Vídeos relacionados

Figura 4. A eliminação da PCM1 leva à motilidade ciliar anormal das MTECs.2
Condições da formação de imagem
Sistema: IXplore SpinSR (modo de super-resolução)
Lente objetiva: APON60XOTIRF (1,49 AN)
Tempo de exposição: 14 milissegundos
Tempo de aquisição: 15 milissegundos, intervalo de 3 segundos
Como o sistema de microscópio de super-resolução IXplore SpinSR facilitou o experimento
O sistema de formação de imagem de super-resolução IXplore SpinSR permite a observação de espécimes em tempo real. Ele emprega a tecnologia confocal de disco giratório para uma aquisição de imagem rápida com a mínima fototoxicidade das células vivas.
A observação com lapso de tempo é uma ferramenta comum na pesquisa biológica para capturar as mudanças e os fenômenos nas estruturas intracelulares, mas requer configurações adaptadas às condições de observação necessárias para capturar essas mudanças. O sistema IXplore SpinSR permite que a formação de imagem em super-resolução de células vivas capture as mudanças rápidas e os fenômenos corretos minimizando a fototoxicidade tanto quanto possível.
Além do desempenho do hardware, a alta velocidade do processamento de dados do sistema IXplore SpinSR possibilita imagens de super-resolução em uma janela de exibição em tempo real.
Recursos principais:
- Resolução horizontal: 110 nm (combinação de discos Sora)
- Escaneamento de alta velocidade
- Formação de imagens a cores de super-resolução
- Fácil de configurar
| AgradecimentosEste artigo foi escrito em colaboração com Yan Xiumin, do Instituto de Bioquímica e Biologia Celular de Xangai, da Academia Chinesa de Ciências. |
Referências
1. Huijie Zhao et al. "The Cep63 paralogue Deup1 enables massive de novo centriole biogenesis for vertebrate multiciliogenesis." Nature Cell Biology, nº 15 (Dez. de 2013): 1434–1444. doi: 10.1038/ncb2880.
2. Huijie Zhao et. al. "Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly." Nature Communications, nº 12: 1273 (Fev. de 2021). doi.org/10.1038/s41467-021-21506-8.
Produtos usados nesta aplicação
foi adicionado com sucesso aos seus favoritos
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
