고속 라이브 셀 이미징을 사용하여 운동성 다중섬모(Motile Multicilia)의 적절한 조립을 위한 조절 메커니즘 밝혀내기
이 애플리케이션 노트에서는 섬모에 대해 소개하고, 섬모가 형성되고 이동하고 조립되는 방식을 탐구합니다.고속 라이브 셀 이미징을 사용한 연구에서 운동성 다중섬모의 적절한 조립을 위한 조절 메커니즘이 밝혀지는 방식에 대해 알아보세요.
섬모 알아보기
섬모는 동물 세포에서 매우 다양한 필수 기능을 수행하는 모발 모양의 구조입니다.이러한 기능은 이동, 환경 감지 및 먹이 섭취를 포함합니다.섬모는 직경이 약 0.2μm, 길이는 10μm입니다.
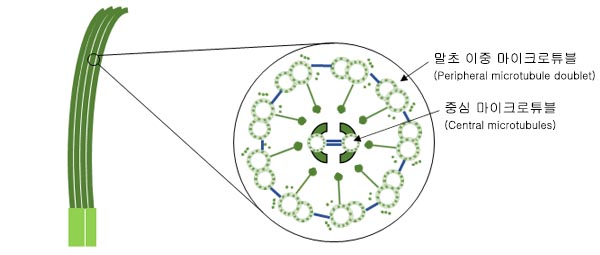
그림 1.섬모 구조의 도식도.
이동할 때, 섬모는 세포를 움직이는 패들의 역할을 수행합니다.연못과 시냇물에 서식하는 미생물인 Paramecia는 조그마한 노처럼 움직여 생물이 물속에서 추진력을 제공하는 섬모로 덮여 있습니다.
더 큰 동물의 경우 섬모는 보다 복잡한 기능을 맡습니다.섬모는 정자와 난자가 결합하도록 미는 것과 같은 움직임에 대한 동력원을 제공합니다.일부 섬모는 안테나처럼 작동하여 외부 자극을 감지합니다.
인체의 거의 모든 유형의 세포를 포함하여 대부분의 동물 세포는 표면에 섬모가 있습니다.섬모는 운동성 섬모와 고정 섬모로 나뉘며 대부분의 운동성 섬모는 군집으로 존재합니다.다중섬모 세포(MCC)는 세포의 표면 위로 액체를 밀어내는 데 사용되는 수백 개의 운동성 섬모를 포함하고 있는 상피세포입니다.이들은 신체 전반의 다양한 표면과 내벽을 덮고 있는 얇은 조직인 상피 조직에 주로 분포되어 있습니다.기도에서 다중섬모 세포는 점액 및 기타 자극원을 체내로부터 청소하고 제거합니다.성인의 척수 및 뇌실에서는 중추 신경계를 통해 뇌척수액을 이동시킵니다.
섬모가 적절히 작동하지 못했을 경우, 인체 건강에 광범위한 영향을 초래할 수 있습니다.인체 섬모 이상을 초래하는 유전병을 섬모 질환이라고 통칭합니다.섬모 질환의 수는 신체 내부의 여러 장기에 흔히 영향을 미치는 다양한 희귀병과 더불어 계속해서 증가하고 있습니다.섬모가 형성되고 이동하고 조립되는 방식에 대한 이해를 넓히면 연구자들이 이러한 질병에 대해 더 자세히 알 수 있습니다.
중심소체와 섬모의 관계
중심소체는 섬모와 중심체 형성 모두에 필수적인 원통 모양의 구조체입니다.세포에서 중심소체는 보통 쌍으로 나타납니다.일부 특정 단백질은 각 중심소체 쌍 주변으로 모여 세포 내 마이크로튜블을 성장시키고 고정하는 역할을 하는 소기관인 중심체를 형성합니다.중심체는 세포의 마이크로튜블을 조직하는 주요 중심 기관 및 세포 분열을 조절하는 역할을 합니다.
세포가 분열 전에 염색체를 복제하는 동안, 두 개의 중심소체가 분리되어 각각 딸 중심소체를 성장시켜 두 개의 중심체를 형성합니다.그 후, 어미-딸 중심소체 쌍과 그 주변의 방사형 마이크로튜블로 구성된 이러한 두 개의 중심체는 유전 물질(염색체)을 두 개의 딸세포에 균등하게 분배하는 역할을 하는 방추체를 형성합니다.분열 이후, 각 딸세포는 동일한 수의 염색체 및 중심체를 얻습니다.
세포가 비증식 상태에 있을 때, 어미 중심소체는 세포막에 고정되고 섬모가 그 끝에서 성장합니다.세포가 증식을 시작하게 될 때, 섬모는 점차 짧아지고 세포 분열 전에 완전히 사라집니다.이는 중심체가 세포질 내로 들어가 방추체를 형성할 수 있도록 합니다.이러한 방식으로 중심소체는 중심체 및 섬모를 형성하는 두 가지 다른 역할을 맡습니다.
여러 개의 새로운 중심소체가 자연적으로 나타나는 이유 이해하기
중심소체는 세포 주기당 한 번씩 복제되는데, Paramecia의 섬모와 같은 다중섬모 세포 내의 수많은 중심소체는 어디서 오는 것일까요?1960년대 초기부터, 세포 생물학자들은 전자 현미경을 사용하여 다중섬모 세포가 형성되는 동안 중심소체의 수가 급증하는 것을 관찰했습니다.또한 더 많은 중심소체가 전중심소체라고 불리는 많은 원형 구조 주변에 형성된다는 것을 예기치 않게 발견했습니다.
수십 년이 지난 지금까지도 새로운 중심소체가 전중심소체 주변에 자연적으로 나타나는 이유에 대해서는 거의 알려진 것이 없습니다.2013년에 저희 실험실의 연구를 통해 비로소 미스터리가 풀렸습니다.1 저희는 한 쌍의 동종단백질인 Deup1과 Cep63이 고등 동물에서 여러 섬모를 생성하는 과정에서 새로운 형성(즉, 기존 중심소체 없이 중심소체 조립)과 어미 중심소체 의존적 형성의 두 가지 중심소체 증폭 모드를 각각 조절한다는 것을 발견했습니다.이것으로 다중섬모 세포 내의 많은 새로운 중심소체들의 기원이 명확해졌습니다.
운동성 섬모의 정밀한 조립
운동성 섬모는 다중섬모 세포 분화 도중 대량으로 합성되는 수백 개의 단백질 성분을 포함하고 있습니다.이들이 자연적으로 조립되는지 혹은 특정한 방식으로 조직되어 필요에 따라 저장되는지는 또 다른 중요하고 밝혀지지 않은 과학상의 질문입니다.
저희가 발표한 연구 결과에 따르면, 다중섬모 세포의 고유한 세포 내 구조인 섬유과립 물질(FGM)이 운동성 섬모의 정밀한 조립을 조절하는 조직자로서 중요한 역할을 맡고 있다는 것이 밝혀졌습니다.2
섬유과립은 고등 생물 다중섬모 세포 내에서만 나타나는 세포 내 구조입니다.1960년대의 전자 현미경 연구에서 발견되기는 했지만, 중심체 주변 매트릭스 단백질(PCM1)을 포함하고 있다는 사실을 제외하면 이들의 구성과 기능은 아직도 불분명합니다.우리는 단백질체학, 초고분해능 현미경, 라이브 셀 고속 현미경 및 여러 전자 현미경 기술을 결합하여 다음과 같은 사실을 발견했습니다.
- 섬유과립은 중심체 주변 매트릭스 단백질 상분리에 의해 형성되는 크고 액체성의, 세포막이 없는 소기관이며, 중심소체에 부착되어 특정 기질 및 섬모의 많은 구조 단백질로 자신의 뽕나무 모양의 구조를 증진시킵니다.이러한 구조 단백질은 섬모 형성의 여러 다른 단계에서 매트릭스 및 섬모 내에 위치하게 됩니다.
- 중심체 주변 매트릭스 단백질의 단백질 수준을 인위적으로 낮추면 다중섬모 세포가 섬유 입자를 형성하지 못하게 막고 전중심소체의 수, 크기 및 분배가 비정상적으로 나타나게 됩니다.비록 이러한 세포들이 결국 대조군 세포와 동일한 수의 섬모를 형성하기는 했지만, 섬모와 매트릭스의 구조에는 중대한 결함이 있었습니다.이는 섬모의 운동 방식과 운동 능력에 심각한 이상을 야기했습니다.
- 심층 분석에 따르면 섬유 입자에 증진된 성분이 먼저 매트릭스에 위치했으며 섬모의 중심 마이크로튜블 기저부 구조가 크게 확장된 것으로 밝혀졌습니다.이는 조립의 시간 순서가 어긋나게 되어 운동성 섬모 구조의 정확성 및 기능에 영향을 미쳤음을 나타냅니다.
따라서, 섬유과립은 섬모 관련 성분의 저장 공간으로서 기능과 전중심소체에 부착되어 새로운 섬모의 기저부를 증진시키는 기능 둘 모두를 통해 운동성 섬모의 미세 구조가 적절하게 조립될 수 있도록 다중섬모 세포의 분화 시 조직자의 기능을 수행합니다.
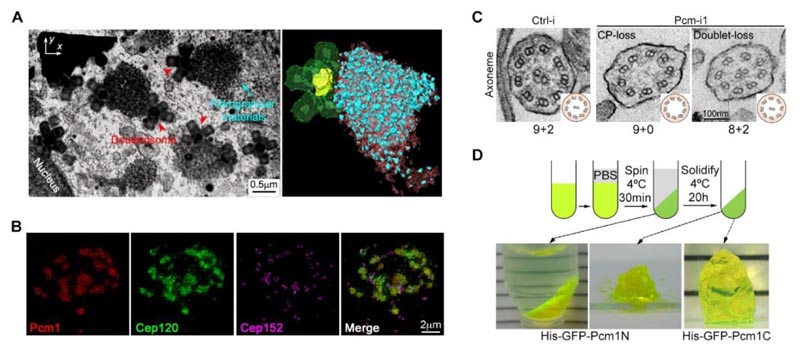
그림 2.(A) 집속 이온 빔 스캐닝 전자 현미경(FIB-SEM)을 통해 다중섬모 세포에서 섬유 입자 및 전중심소체의 공간 분포를 확인했습니다.(B) 섬유 입자 구조는 매트릭스의 구조 단백질 Cep120을 증진시킬 수 있습니다.(C) 중심체 주변 매트릭스 단백질의 단백질 수준을 낮추면 움직이는 섬모의 초미세 구조에 명백한 결함이 생기게 됩니다.(D) 중심체 주변 매트릭스 단백질 단편은 상분리 특성을 가지고 있습니다.2
운동성 다중섬모의 적절한 조립 분석하기
저희 연구에서는,2 초고분해능 현미경, 라이브 셀 고속 현미경 및 전자 현미경을 포함한 다양한 이미징 기술을 사용했습니다.Evident의 IXplore™ SpinSR 초고분해능 현미경이 작업의 중심이었습니다.다음 내용은 저희 연구에서 IXplore SpinSR 시스템의 실질적인 적용을 세부적으로 소개합니다.
아데노바이러스 및 렌티바이러스에 감염된 마우스 심실뇌실막상피세포(mEPC)의 2채널 라이브 셀 이미징을 수행하여 GFP-PCM1 및 Deup1 촉진자 하에서 SNAP-Deup1을 발현시켰습니다.
IXplore SpinSR 시스템에서 체내 라이브 이미징을 사용하여 마우스 심실뇌실막상피세포에서 GFP-PCM1의 동적인 행동을 관찰했습니다.SNAP-Deup1의 발현이 Deup1 촉진자에 의해 제어되기 때문에, SNAP-Deup1 양성 점의 출현은 세포가 중심소체 확장 중임을 나타냅니다.
이미징 결과는 다음을 보여주었습니다.
- 마우스 심실뇌실막상피세포에서 SNAP-Deup1 라벨링된 전중심소체와 GFP-PCM1 라벨링된 섬유과립 물질 간이 명백히 공존했습니다.크기는 다르지만, 함께 움직입니다.
- 더 큰 크기의 섬유과립 물질 점은 전중심소체를 완전히 감싸고 있는 것처럼 보이며, 간혹 여러 개의 전중심소체가 커다란 섬유과립 물질 점에 갇혀 있는 것처럼 보이기도 합니다.
- 두 개의 섬유과립 물질 점이 만나면 더 큰 섬유과립 물질 점으로 점차 합쳐져서 내부 전중심소체가 서로 융합됩니다(그림 3).따라서, 이러한 실험은 섬유과립 물질이 액체 특성을 가지고 있고 전중심소체에 견고하게 결합된다는 것을 입증했습니다.
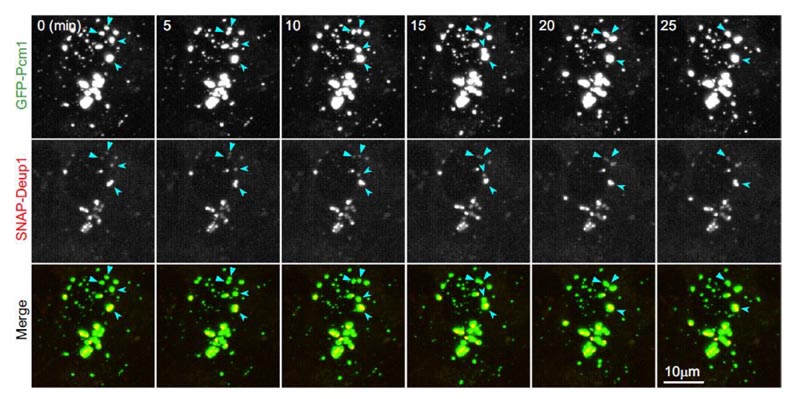
그림 3.살아있는 마우스 심실뇌실막상피세포의 섬유과립 물질은 액체 특성이 있으며 전중심소체에 견고하게 결합합니다.섬유과립 물질 점은 액체 특성이 있으며 전중심소체에 결합합니다.살아있는 마우스 심실뇌실막상피세포는 3일 차에 실시간으로 5분마다 이미징됩니다.GFP-PCM1 및 SNAP-Deup1은 각각 섬유과립 물질 및 전중심소체를 나타냅니다.화살표는 이미지 시퀀스에서 두 개의 섬유과립 물질의 융합 이벤트를 나타냅니다.2
이미징 조건
시스템: IXplore SpinSR 시스템(공초점 모드)
대물렌즈: APON60XOTIRF/개구수 1.49
노출 시간: 100밀리초
지속 시간: 65분간 5분마다
또한, Transwell에서 성장한 마우스의 기관상피세포(MTEC)를 200nM SiR-튜불린으로 배양하여 다중섬모를 형광으로 라벨링했습니다.저희는 GFP-Centrin1 양성인 마우스 기관상피세포의 운동 궤적을 포착하기 위해 IXplore SpinSR 시스템의 고속 이미징을 사용하여, 운동성 섬모는 주로 대조군 세포에서 규칙적인 물결 모양의 움직임을 보여준 반면 중심체 주변 매트릭스 단백질이 억제된 마우스 기관상피세포에서는 운동성 섬모가 불규칙적으로 회전하거나 운동 능력을 완전히 상실했음을 발견했습니다(그림 4).
관련 영상

그림 4.중심체 주변 매트릭스 단백질을 제거하면 마우스 기관상피세포의 섬모 운동성이 비정상적으로 나타나게 됩니다.2
이미징 조건
시스템: IXplore SpinSR 시스템(초고분해능 모드)
대물렌즈: APON60XOTIRF(개구수 1.49)
노출 시간: 14밀리초
획득 시간: 15밀리초 간격, 3초
IXplore SpinSR 초고분해능 현미경 시스템이 실험을 용이하게 만든 방식
IXplore SpinSR 초고분해능 이미징 시스템을 통해 표본을 실시간으로 관찰할 수 있습니다.회전 디스크 공초점 기술을 채택하여 생세포에 대한 광독성을 최소화하고 빠르게 이미지를 획득합니다.
타임랩스 관찰은 생물학 연구에서 세포 내 구조 및 현상의 변화를 포착하기 위한 일반적인 도구이지만, 이러한 변화를 포착하기 위해 필요한 관찰 조건에 맞추어진 설정이 요구됩니다.IXplore SpinSR 시스템은 라이브 셀 초고분해능 이미징을 지원하여 빠른 변화를 포착하고 광독성을 가능한 한 최소화하여 정확한 현상을 포착합니다.
하드웨어 성능뿐만 아니라, IXplore SpinSR 시스템의 고속 데이터 처리를 통해 라이브 디스플레이 창에서 초고분해능 이미지를 구현할 수 있습니다.
주요 기능:
- 수평 분해능: 110nm(소라 디스크 결합)
- 고속 스캐닝
- 다색 초고분해능 이미징
- 간편한 설치
| 감사의 말이 글은 중국과학원 상하이 생화학 세포 생물학 연구소의 Yan Xiumin과 공동 집필했습니다. |
참고 문헌
1.Huijie Zhao et al.“The Cep63 paralogue Deup1 enables massive de novo centriole biogenesis for vertebrate multiciliogenesis.”Nature Cell Biology, no.15(2013년12월): 1434~1444. doi: 10.1038/ncb2880.
2.Huijie Zhao et. al.“Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly.”Nature Communications, no.12: 1273(2021년2월). doi.org/10.1038/s41467-021-21506-8.
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.
