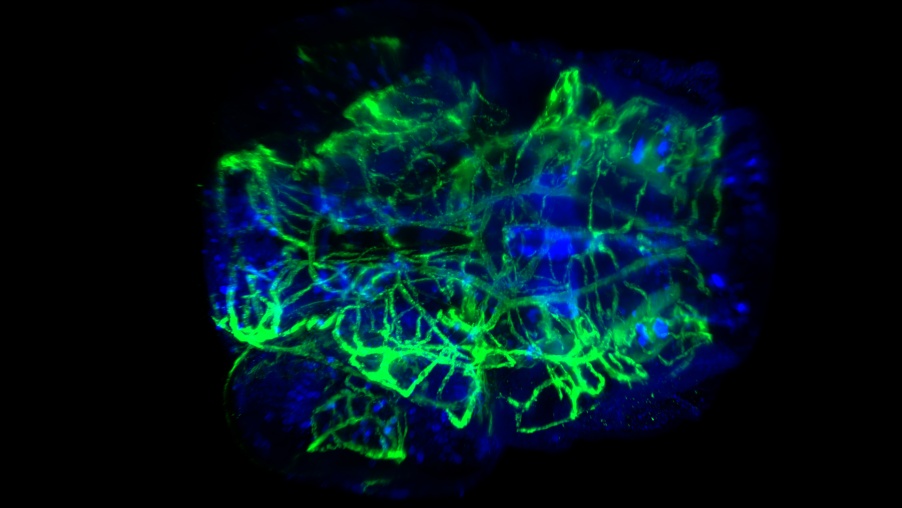
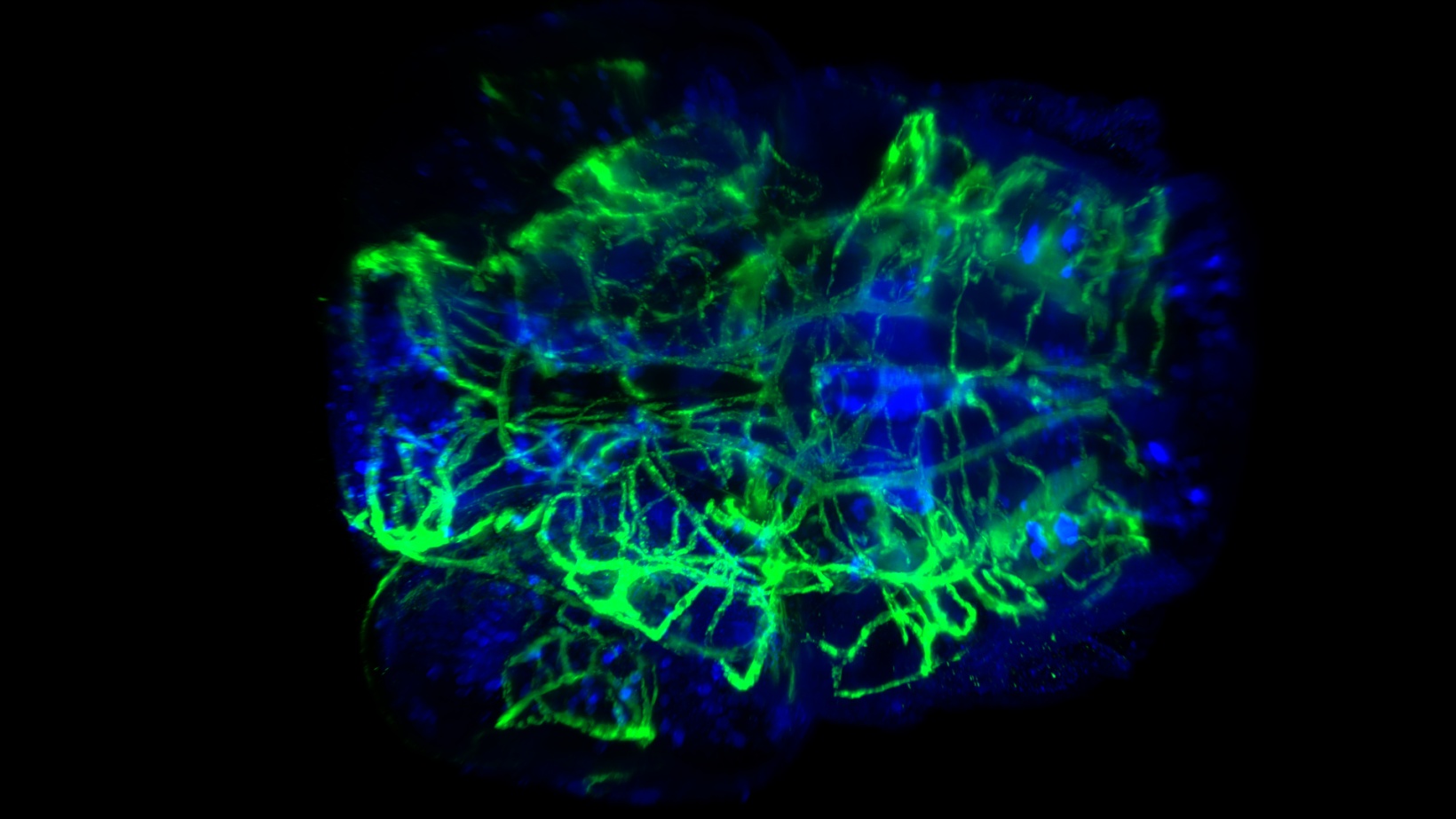
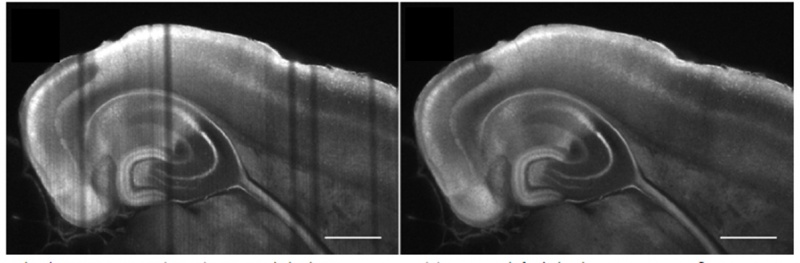
Tinción neuronal y vascular en la cabeza de una larva de pez cebra aclarada. Captura bajo magnificación de 20x con una A. N. de 0,5 y CUBIC-2. Imagen por cortesía de P. Affaticati & A. Jenett of the Tefor Facility, Francia.
Vivimos en un mundo tridimensional que cambia constantemente. No obstante, en microscopía, nuestra capacidad para visualizar imágenes 3D y contar con las velocidades necesarias para observar los procesos vivos y rápidos sigue siendo un desafío. Al ser comparada con otras técnicas de microscopía óptica, la microscopía de fluorescencia puede conseguir altos niveles de especificidad y contraste, pero sigue teniendo limitaciones importantes a nivel de la fototoxicidad y relación entre la señal y el ruido.
Los métodos tradicionales, como la microscopía confocal, eliminan la luz fuera del enfoque, un proceso conocido como seccionamiento óptico, usando un estenopo dentro del plano focal. Aunque este método ofrece una relación optimizada entre señal y ruido, la muestra debe exponerse repetidamente a grandes cantidades de luz fuera del enfoque, lo que aumenta la posibilidad de sufrir fotoblanqueo.
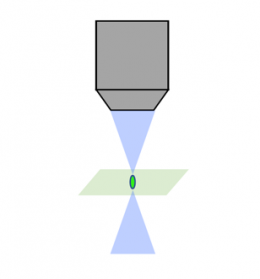 Escaneo láser confocal | 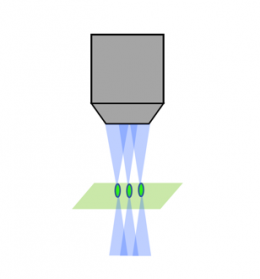 Confocal de disco giratorio | 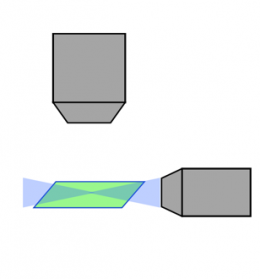 Lámina/hoja de luz |
Y, entonces, se hizo la luz: Aparición de la microscopía de lámina/hoja de luz
A principios de la década de 1900, los científicos empezaron a buscar una forma de mejorar el procesamiento de imágenes biológicas. Esta tecnología apareció en 1902 con un dispositivo óptico denominado «ultramicroscopio», desarrollado por Richard Zsigmondy y Henry Siedentopf (Heddleston & Chew, 2016; Adams, et al., 2016). Este primer microscopio de lámina de luz se apartaba de la arquitectura óptica tradicional al separar la trayectoria de luz de detección y de iluminación con el fin de crear el primer microscopio de lámina de luz ortogonal.
Casi 100 años después, Voie et al. publicaron las primeras imágenes de un microscopio de fluorescencia de lámina de luz (LSFM), usando la arquitectura del plano ortogonal para seccionar ópticamente la cóclea de una cobaya (Heddleston & Chew, 2016; Adams, et al., 2016). De forma más reciente, se han desarrollado variantes del LSFM para visualizar bacterias, drosófilas, peces cebra y otros tejidos.
El microscopio de fluorescencia de lámina de luz más cerca del público general
Los sistemas modernos de LSFM, también conocida como microscopía de iluminación de plano selectivo (SPIM), emplean variaciones de las arquitecturas ortogonales, como sus predecesores, pero usan lentes cilíndricas para producir una lámina fina de luz para el seccionamiento óptico. Esta lámina fina de luz solo excita una subregión de la muestra dentro del plano focal del objetivo en el procesamiento de imágenes. En combinación con una cámara CMOS de alta velocidad para la recogida de emisiones, el LSFM proporciona profundidades de muestreo superiores, una relación entre señal y ruido optimizada, y velocidades superiores en el procesamiento de imágenes para reducir la fototoxicidad frente a las tecnologías confocales tradicionales.
Actualmente, el procesamiento de imágenes por fluorescencia de lámina de luz es reconocido como una técnica de microscopía clave para investigar los órganos enteros o las muestras vivas. Sin embargo, su desarrollo entre la comunidad científica sigue siendo limitado debido al alcance relativamente limitado y a la poca capacidad de adaptación a los sistemas de los modelos actuales. En los últimos años, la disponibilidad de sistemas LSFM existentes ha aumentado para satisfacer las necesidades de los investigadores dentro de los campos biológicos. No todos los sistemas han sido construido de la misma forma y es importante considerar de qué forma las distintas características satisfacen sus necesidades.
Cuatro consideraciones importantes al comparar los sistemas LSFM
A la hora de escoger el sistema de fluorescencia de lámina/hoja de luz más adecuado para nosotros, es importante considerar varios factores importantes.
- Primero que todo, la preparación de las muestras:
A diferencia de la microscopía tradicional en la que se suele seccionar grandes muestras fijas que, posteriormente, son cargadas en los portaobjetos, las muestras en la microscopía de lámina/hojas de luz permanecen intactas para la observación y, por lo tanto, deben ser aclaradas por un procesamiento óptico, lo que supone hacerlas ver transparentes. Existen varios protocolos para aclarar los diversos tejidos y también existen muchas soluciones de aclaramiento en el mercado. Se recomienda el siguiente recurso «A beginner’s guide to tissue clearing» de Pablo Ariel (Int J Biochem Cell Biol. 2017 Mar. 84: 35–39) para familiarizarse con los métodos más populares. - Arquitectura óptica:
La arquitectura óptica para la trayectoria de iluminación y de detección puede afectar en gran medida a la naturaleza y el tamaño de las muestras bajo observación, así como a la calidad de su imagen. Los artefactos de rayado, por ejemplo, se deben a la luz emitida que refracta fuera de una estructura opaca dentro de la muestra. Para solucionar este problema, se ha diseñado una gran cantidad de arquitecturas ópticas para adquirir imágenes en muestras vivas o limpias de todos los tamaños. Un ejemplo de estas arquitecturas es el SPIM multidireccional (mSPIM), en el que las diversas trayectorias de iluminación se alinean para iluminar la muestra y corregir los artefactos de rayado. Aunque los sistemas mSPIM pueden ofrecer un rendimiento óptico para aplicaciones específicas, también comparten limitaciones a nivel de flexibilidad, modularidad y uso práctico, que deben tenerse en cuenta a la hora de escoger el sistema más adecuado para su investigación.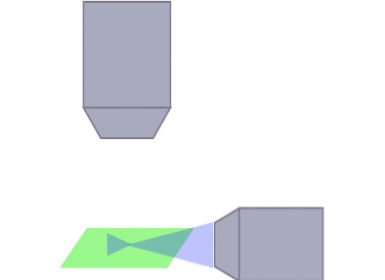
SPIM
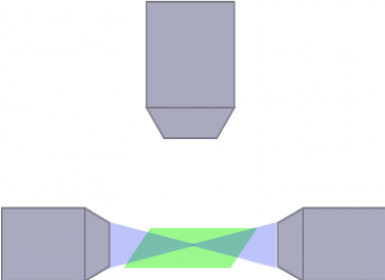
mSPIM
(Schwarz, et al. PLoS One, 2015)
- Flexibilidad de la muestra:
Si bien los sistemas LSFM cubren un campo en plena expansión con nuevos diseños anualmente, dicha panoplia de diseños hace que exista un alto nivel de variación en cuanto a los tipos de muestras que pueden alojar. Es decir que algunos sistemas solo pueden visualizar muestras pequeñas como los esferoides, mientras que otros solo pueden visualizar tejidos grandes. También pueden verse limitados con respecto al procesamiento de imágenes de muestras fijas o vivas. Aunque este tipo de especificidad puede ser idónea para un único usuario centrado en un tipo de muestra, la capacidad de compartir el equipo con todo un departamento de investigación o de ampliar las investigaciones se ve comprometida. Es importante considerar todos los tipos de muestras potenciales que su sistema LSFM tendrá que gestionar. Recientemente, se han diseñado sistemas LSFM de mayor flexibilidad para contrarrestar tal diferencia en la variación de las muestras. El microscopio de fluorescencia de lámina/hoja de luz Alpha3, por ejemplo, puede alojar una amplia variedad de muestras, desde células únicas a cerebros de ratón enteros, inclusive organismos vivos.* - Gestión de datos:
Por último, y puede que el más importante, existe la gestión de datos. No es raro que un único experimento genere 100 GB o incluso varios TB de datos. Se recomienda encarecidamente trabajar con su departamento de información tecnológica a fin de crear un plan que satisfaga sus necesidades en cuanto al almacenamiento de datos. Asimismo, tenga en cuenta que tendrá que comprar un paquete de software individual para interpretar y analizar estas grandes cantidades de datos.
Contenido relacionado
Galería de imágenes digitales de fluorescencia de Olympus
*El sistema Alpha3 no está disponible en todas las regiones. Contacte con un representante local de Olympus para obtener más información al respecto.