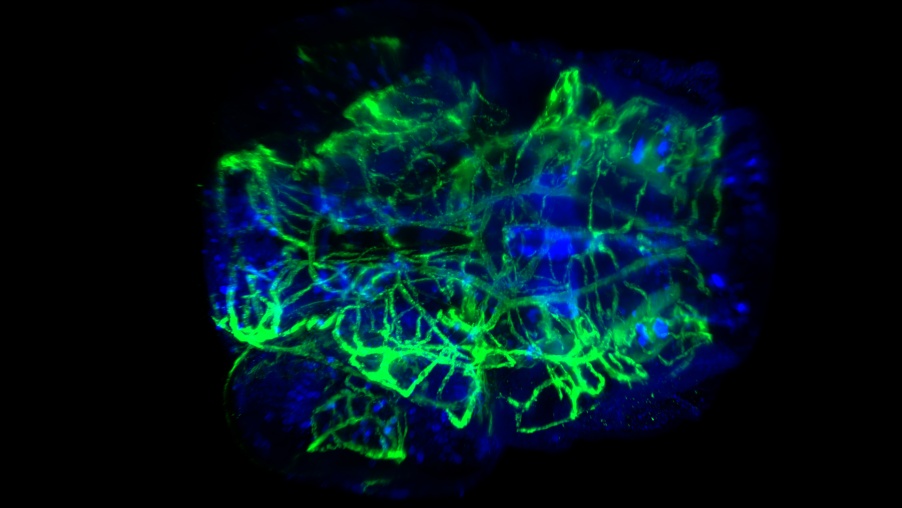
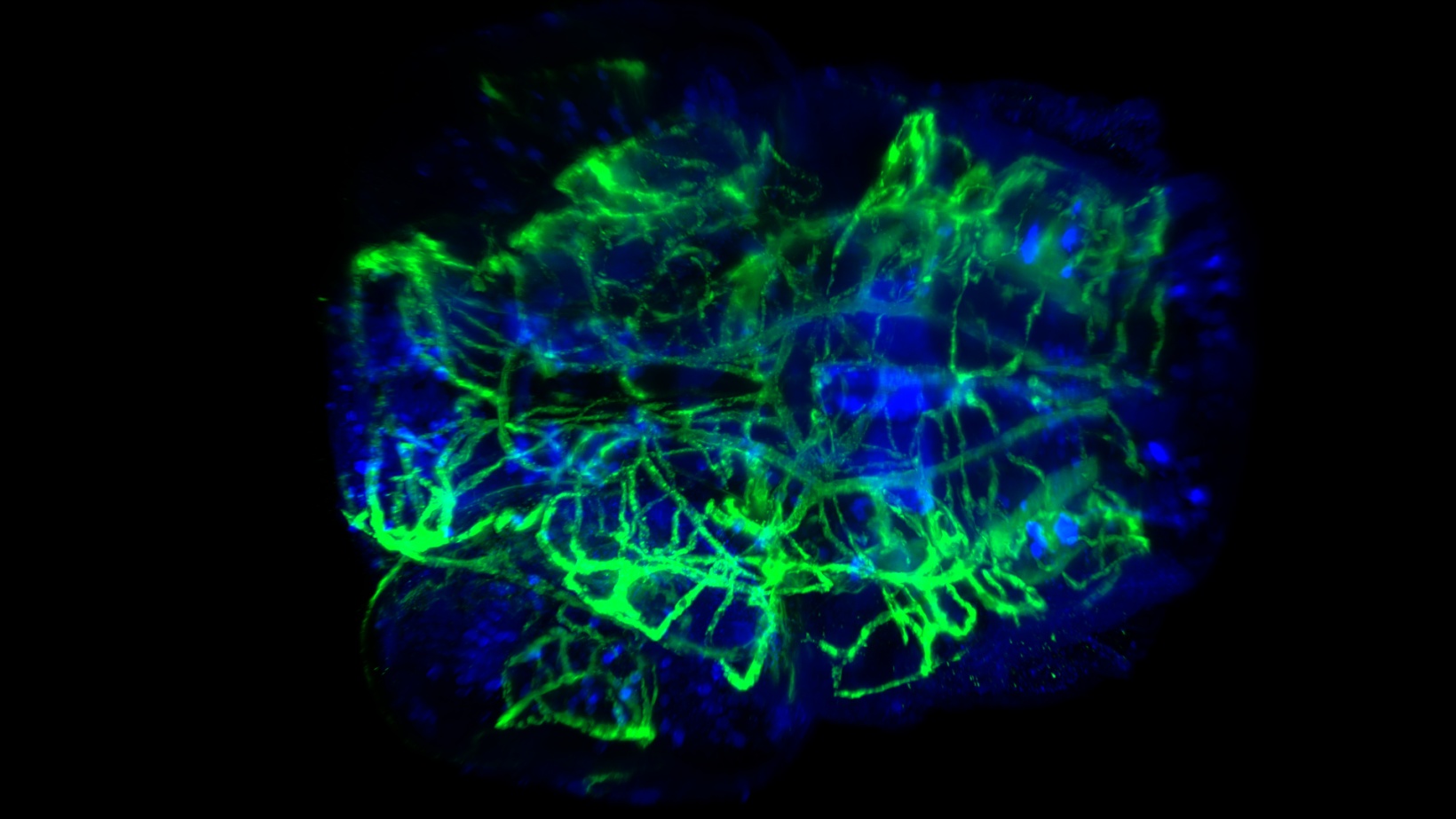
Coloração vascular e neural clara da cabeça de larvas de peixe-zebra. Captadas a 20x com AN de 0,5 e CUBIC-2. Imagem:cortesia de Affaticati & A. Jenett da instalação Tefor, França.
Vivemos em um mundo tridimensional em constante mudança. No entanto, em microscopia a nossa capacidade de projetar em 3D e às velocidades necessárias para observar processos vitais rápidos continua sendo um desafio. Em comparação com outras técnicas de microscopia de luz, a microscopia de fluorescência pode alcançar uma especificidade e um contraste elevados, apesar de ainda existirem grandes limitações na relação sinal-ruído e na fototoxicidade.
As abordagens tradicionais, como a microscopia confocal, eliminam a luz fora de foco, um processo conhecido como segmentação óptica, usando um pinhole no plano focal. Apesar de este método oferecer uma relação sinal-ruído aumentada, a amostra deve ainda ser exposta repetidamente a grandes quantidades de luz fora de foco, aumentando a probabilidade de fotobranqueamento.
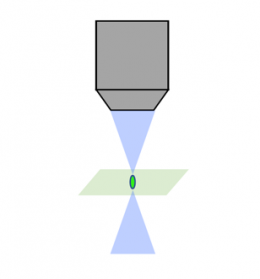 Análise a laser confocal | 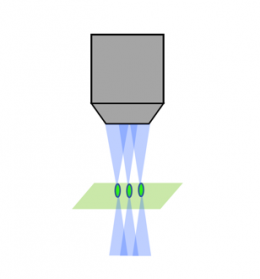 Disco giratório confocal | 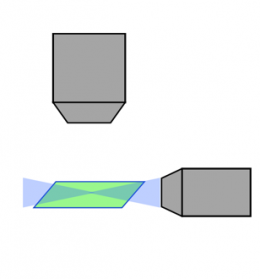 Luz-folha |
E, depois, houve luz – O surgimento da microscopia de luz-folha
No início de 1900, os cientistas começaram a procurar uma forma de melhorar a formação de imagem biológica. Essa tecnologia surgiu em 1902 com o dispositivo óptico designado "Ultramicroscópio", desenvolvido por Richard Zsigmondy e Henry Siedentopf (Heddleston & Chew, 2016; Adams et al., 2016). Este microscópio de luz-folha inicial se afastou da arquitetura óptica tradicional separando os caminhos de luz de detecção e iluminação, criando o primeiro microscópio de luz-folha ortogonal.
Quase 100 anos depois, Voie et al. publicou as primeiras imagens do microscópio de fluorescência de luz-folha (LSFM), usando a arquitetura de plano ortogonal para segmentar opticamente a cóclea da cobaia (Heddleston & Chew, 2016; Adams et al., 2016). Mais recentemente, variações de LSFM foram desenvolvidas para bactérias de imagem, drosófila, peixe-zebra e outros tecidos.
Popularização do microscópio de fluorescência de luz-folha
Os sistemas LSFM modernos, também conhecidos como microscopia de iluminação do plano seletivo (SPIM), aplicam variações de arquiteturas ortogonais como os seus antecessores, apesar de usarem lentes cilíndricas para produzir uma camada fina de luz para segmentação óptica. Esta camada fina de luz excita somente uma sub-região da amostra no plano focal da objetiva de formação de imagem. Em combinação com a câmera sCMOS de alta velocidade para a coleta de emissões, o LSFM fornece maiores profundidades de amostragem, uma relação sinal-ruído melhorada e maiores velocidades de formação de imagem para fototoxicidade reduzida comparativamente às tecnologias confocais tradicionais.
A formação de imagem de fluorescência de luz-folha é agora reconhecida como a principal técnica de microscopia para investigar órgãos inteiros ou espécimes vivos. Porém, o seu desenvolvimento na comunidade científica é ainda dificultado pelo alcance e pela capacidade relativamente limitada de adaptação aos sistemas de modelo atuais. Nos últimos anos, os sistemas LSFM prontos para uso têm-se tornado mais disponíveis para atender as necessidades dos pesquisadores nos campos biológicos. Nem todos os sistemas são construídos da mesma forma e é importante considerar como as diferentes características atendem às suas necessidades.
Quatro considerações importantes ao comparar sistemas LSFM
Existem várias características importantes que você deve ter em consideração ao decidir qual o melhor sistema de fluorescência de luz-folha para você.
- Em primeiro lugar, a preparação da amostra:
Ao contrário da microscopia tradicional em que grandes amostras fixas são geralmente divididas em lâminas, as amostras de microscopia de luz-folha são captadas em imagem de forma intacta e, como tal, devem ser limpas opticamente, o que implica torná-las transparentes. Existem muitos protocolos para limpar vários tecidos e muitas soluções de limpeza também estão disponíveis comercialmente. Eu recomendaria ler “A beginner’s guide to tissue clearing” por Pablo Ariel (Int J Biochem Cell Biol. 2017 Mar. 84: 35–39) para obter uma análise de alguns métodos populares. - Arquitetura óptica:
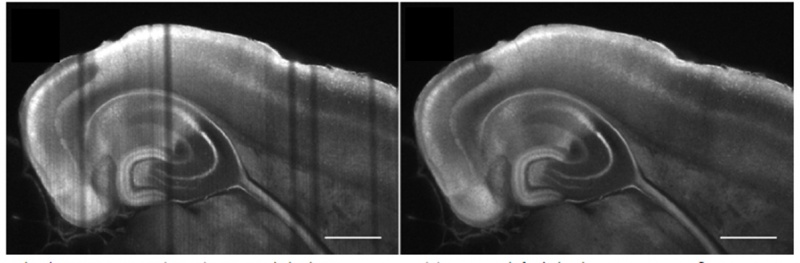
A arquitetura óptica para a iluminação e o caminho de detecção podem ter um impacto forte na natureza e no tamanho das amostras que podem ser observadas, bem como na qualidade da sua imagem. Os artefatos com aspecto listrado, por exemplo, são causados pela luz emitida refratada de uma estrutura opaca em uma amostra. Para superar este problema, um grande número de arquiteturas ópticas foi desenvolvido para a aquisição de imagem em amostras claras ou vivas de todos os tamanhos. Um exemplo destas arquiteturas é a SPIM multidirecional (mSPIM), na qual vários caminhos de iluminação são alinhados para iluminar a amostra e superar artefatos com aspecto listrado. Embora os sistemas mSPIM possam oferecer um desempenho ideal para aplicações específicas, todos compartilham limitações de flexibilidade, modularidade e uso prático, o que deve ser considerado ao selecionar um sistema que melhor se adéque à sua pesquisa.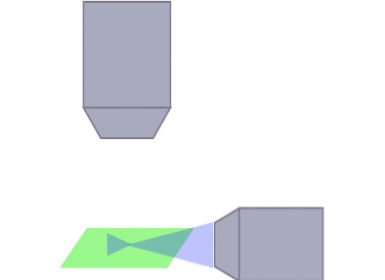
SPIM
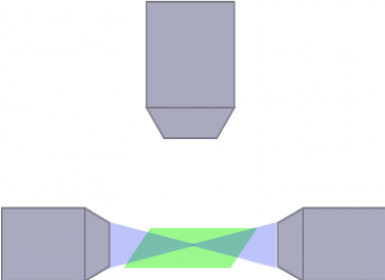
mSPIM
(Schwarz, et al. PLoS One, 2015)
- Flexibilidade da amostra:
Apesar de o LSFM ser um campo em expansão com novos sistemas chegando ao mercado todos os anos, devido ao seu design diferente existe um nível alto de variação no que diz respeito aos tipos de amostras que eles podem acomodar. Alguns sistemas podem projetar somente amostras menores como esferoides, ao passo que outros projetam somente tecidos maiores. Isso também pode estar limitado à formação de imagem de espécimes fixos ou vivos. Embora este tipo de especificidade possa ser ideal para um único usuário que se concentre em uma categoria de amostra, a capacidade de compartilhar equipamento com todo um departamento de pesquisa ou de expandir a sua própria pesquisa é comprometida. É importante considerar todos os possíveis tipos de amostra que o seu sistema LSFM deverá ser capaz de processar. Recentemente, foram desenvolvidos sistemas LSFM mais flexíveis para superar a diferença na variação da amostra. O microscópio de fluorescência de luz-folha Alpha3, por exemplo, pode acomodar uma ampla variedade de espécimes, desde células únicas a cérebros de camundongos inteiros, incluindo organismos vivos.* - Gerenciamento de dados:
Em último lugar e o mais importante é o gerenciamento de dados. Não é novidade um único experimento alcançar 100 Gigabytes (GB) e até Terabytes (TB) de dados. Recomendamos vivamente que trabalhe com o seu grupo de TI local para criar um plano para as necessidades de dados. Tenha em mente que você poderá precisar adquirir um pacote de software de análise separado para processar e analisar grandes conjuntos de dados.
Conteúdo relacionado
Um século de inovação – A história dos nossos sistemas de formação de imagem em ciências da vida
Galeria de imagens digitais de fluorescência da Olympus
*O sistema Alpha3 não está disponível em todas as regiões. Para mais informações, entre em contato com o seu representante local da Olympus.