Fundamentos de la excitación y emisión de la fluorescencia
Fundamentos de la excitación y emisión de la fluorescencia
Los fluorocromos son compuestos químicos fotorreactivos que absorben la energía de la luz de una cierta longitud de onda y emiten esa luz a una longitud de onda más amplia. Esta capacidad los hace útiles como reactivos de detección en el estudio de células y tejidos. Debido a sus novedosas configuraciones electrónicas, los fluorocromos presentan espectros únicos y característicos de absorción (por lo general, similar a la excitación) y emisión. Estos espectros de absorción y emisión muestran la intensidad relativa de la fluorescencia, junto con la intensidad relativa que se representa de modo clásico en el eje vertical frente a la longitud de onda en el eje horizontal. En el caso de un fluorocromo específico, los fabricantes indican la longitud de onda dispuesta al pico de intensidad de la excitación de iluminación y la longitud de onda dispuesta al pico de intensidad de la emisión de fluorescencia. Es importante comprender el origen de estos gráficos y curvas que muestran los espectros de excitación y emisión de un fluorocromo determinado.
¿Cómo determinar el espectro de emisión de un fluorocromo?
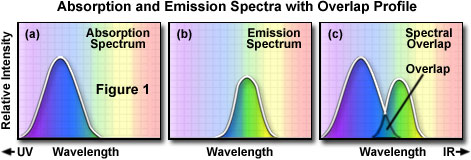
A fin de determinar el espectro de emisión de un fluorocromo en particular, se dispone la longitud de onda de absorción máxima (por lo general, la misma que la de excitación máxima) y el fluorocromo se excita en dicha longitud de onda. El espectro de absorción de un fluorocromo típico se ilustra en la Figura 1(a), y la intensidad relativa de absorción se representa en función de la longitud de onda medida. A continuación, se usa un monocromador (un dispositivo que permite el paso de bandas estrechas de longitudes de onda de luz) para escanear la intensidad de la emisión de fluorescencia en toda la serie de las longitudes de onda de emisión. La intensidad relativa de la fluorescencia se mide en varias longitudes de onda para trazar el espectro de emisión, tal y como se ilustra en la Figura 1(b). El espectro de excitación de un fluorocromo dado se determina de manera similar al monitorizar la emisión de fluorescencia en la longitud de onda de máxima intensidad mientras el fluorocromo se excita a través de un grupo de longitudes de onda consecutivas. En ese punto, se selecciona el valor máximo de emisión y sólo se otorga el paso hacia el detector a la luz de emisión en tal longitud de onda. La excitación es inducida (por lo general a través de un monocromador) en varias longitudes de onda de excitación, y la intensidad de la fluorescencia emitida se mide en función de la longitud de onda. El resultado es un gráfico o curva [que se ilustra en la Figura 1(a)] representando la intensidad de fluorescencia relativa, generada por la excitación sobre el espectro de longitudes de onda de excitación.
Espectro de filtro de fluorescencia
Explore las regiones superpuestas de los perfiles espectrales de excitación de fluorescencia, emisión y filtros dicromáticos, y cómo los cambios en las características de transmisión determinan el ancho de banda de las longitudes de onda que pasan a través de varias combinaciones de filtros.
Observaciones de espectros de excitación y emisión
Es posible llevar a cabo varias observaciones a partir de un conjunto típico de curvas o espectros de excitación y emisión. Por lo general, existe una superposición entre el extremo de longitud de onda superior perteneciente al espectro de excitación y el extremo de longitud de onda inferior perteneciente al espectro de emisión. En la microscopía de fluorescencia, esta superposición de intensidades y longitudes de onda de excitación y emisión [Figura 1(c)] debe eliminarse mediante la selección del adecuado filtro de excitación, divisor de haz (fluorescencia de luz reflejada) y filtro de emisión. De lo contrario, la luz de excitación mucho más luminosa superará a la luz de fluorescencia más débil emitida y disminuirá significativamente el contraste de la muestra.
Ley de Stokes
Cuando los electrones pasan del estado excitado al estado fundamental, hay una pérdida de energía vibratoria (para obtener información sobre este fenómeno, consulte la sección Explicación de la fluorescencia a nivel molecular). Debido a que la longitud de onda es inversamente proporcional a la energía de radiación (ver 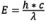 ), la pérdida de energía desplaza el espectro de emisión a longitudes de onda más largas que el espectro de excitación. Este fenómeno es conocido como la Ley de Stokes o el Cambio de Stokes, ya que fue descubierto por Sir George G. Stokes a mediados del siglo XIX. A medida que el Cambio de Stokes es mayor, se vuelve más fácil separar la luz de excitación de la luz de emisión. Para alcanzar la máxima intensidad de fluorescencia, el fluorocromo se excita de forma óptima en la longitud de onda de excitación pico, y la detección de emisión es seleccionada a partir de la longitud de onda pico (u otras longitudes de onda elegidas por el observador) de la curva de emisión. Las selecciones de longitudes de onda de excitación y longitudes de onda de emisión son controladas por filtros apropiados que regulan el paso de las longitudes de onda aceptadas. Al determinar la respuesta espectral de todo el sistema óptico, se requerirán correcciones técnicas adicionales para considerar factores como la transmisión del vidrio y la sensibilidad del detector que varían según las diferentes longitudes de onda.
), la pérdida de energía desplaza el espectro de emisión a longitudes de onda más largas que el espectro de excitación. Este fenómeno es conocido como la Ley de Stokes o el Cambio de Stokes, ya que fue descubierto por Sir George G. Stokes a mediados del siglo XIX. A medida que el Cambio de Stokes es mayor, se vuelve más fácil separar la luz de excitación de la luz de emisión. Para alcanzar la máxima intensidad de fluorescencia, el fluorocromo se excita de forma óptima en la longitud de onda de excitación pico, y la detección de emisión es seleccionada a partir de la longitud de onda pico (u otras longitudes de onda elegidas por el observador) de la curva de emisión. Las selecciones de longitudes de onda de excitación y longitudes de onda de emisión son controladas por filtros apropiados que regulan el paso de las longitudes de onda aceptadas. Al determinar la respuesta espectral de todo el sistema óptico, se requerirán correcciones técnicas adicionales para considerar factores como la transmisión del vidrio y la sensibilidad del detector que varían según las diferentes longitudes de onda.
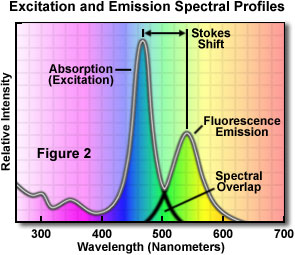
En la Figura 2 se ilustra un diagrama espectral de emisión y absorción de un típico fluorocromo. Tenga en cuenta que las curvas de intensidad de fluorescencia, dedicadas a la absorción (generalmente similar a la curva de excitación para compuestos puros) y emisión de este típico fluorocromo, presentan una forma algo similar. También recuerde que las curvas de excitación y emisión se superponen un poco en el extremo superior de la excitación y las longitudes de onda inferiores de la curva de emisión.
Cubos de filtros de fluorescencia
Descubra cómo las variaciones en la región de la longitud de onda del paso de banda de los filtros de barrera y de excitación permiten que una banda específica de longitudes de onda ilumine la muestra y, a continuación, pase hacia el detector a medida que se excluyen todas las demás.
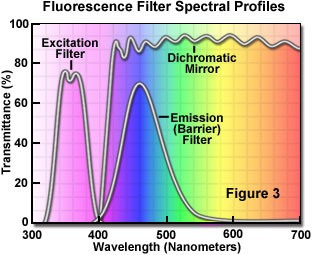
Separación de las longitudes de onda de excitación y emisión
La separación de las longitudes de onda de excitación y emisión se establece mediante la selección adecuada de filtros para bloquear o dejar pasar longitudes de onda específicas del espectro, como se presenta en la Figura 3. El diseño de los iluminadores de fluorescencia se basa en el control de la luz de excitación y de emisión mediante inserciones de filtros fácilmente intercambiables en la trayectoria de la luz hacia la muestra (excitación) y, posteriormente, provenientes de la muestra (emisión). Es importante que la fuente de luz elegida para la excitación, dadas las bajas intensidades de emisión, brinde suficiente iluminación para que la luz de emisión relativamente débil pueda maximizarse, y que se elijan fluorocromos de absorción y rendimiento satisfactorios.
La eficiencia con la que el fluorocromo absorbe la luz de excitación se conoce como coeficiente de extinción molecular. Cuanto más alto es el coeficiente de extinción molecular, mayor es la posibilidad de absorción de luz en una determinada región de la longitud de onda (un requisito previo para la emisión de fluorescencia resultante). El rendimiento de la luz emitida se denomina rendimiento cuántico: la relación entre el número de cuantos emitidos (cantidades discretas de energía) en comparación con el número de cuantos absorbidos (muchos fluorocromos comerciales tienen rendimientos entre 0,1 y 0,9). Los rendimientos cuánticos inferiores a 1 son el resultado de la pérdida de energía a través de vías no radiativas, como el calor o una reacción fotoquímica, en lugar de la vía reradiativa de la fluorescencia. En la Tabla 1 a continuación, se enumeran los rendimientos cuánticos de fluorescencia para un grupo de fluorocromos seleccionados. Note que algunos rendimientos cuánticos parecen triviales (benceno) a diferencia de otros que son muy eficientes (fluoresceína y rodamina B).
Rendimiento cuántico de fluorescencia de fluorocromos
Tabla 1
| Compuesto | Solvente | Longitud de onda de excitación (nm) | Longitud de onda de emisión (nm) | Rendimiento cuántico |
|---|---|---|---|---|
| Naranja de acridina | Etanol | 493 | 535 | 0,46 |
| Benceno | Etanol | 248 | 300-350 | 0,04 |
| Clorofila A | Etanol | 440 | 685 | 0,23 |
| Eosina | Agua | 521 | 544 | 0,16 |
| Fluoresceína | Agua | 437 | 515 | 0,92 |
| Rodamina B | Etanol | 555 | 627 | 0,97 |
El coeficiente de extinción molecular, el rendimiento cuántico, la intensidad luminosa media (brillo intrínseco) de la fuente de luz y la vida útil de la fluorescencia (duración del estado excitado) son todos factores importantes que contribuyen en la intensidad y la utilidad de la emisión de fluorescencia. Además, el entorno localizado que rodea al fluorocromo juega un papel primordial en la determinación de las características de la emisión de fluorescencia. Determinadas variables como la viscosidad del solvente, las concentraciones iónicas, el pH y la hidrofobicidad ambiental pueden tener efectos profundos tanto en la intensidad de la fluorescencia como en la vida útil del estado excitado.
Explicación de la fluorescencia a nivel molecular
Otra forma de representar la actividad de fluorescencia es mediante el uso de un diagrama de Jablonski, como el que se muestra en la Figura 4(a). Antes de la excitación, la configuración electrónica de la molécula se describe como si estuviera en el estado fundamental. Al absorber un fotón de luz de excitación, los electrones pueden alcanzar un estado de excitación vibratoria y de mayor energía en sólo unos pocos femtosegundos (de 10a 15
segundos).
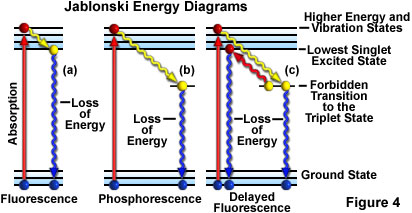
Durante un intervalo de aproximadamente una billonésima de segundo (un picosegundo o 10-12 segundos), los electrones excitados pueden perder algo de energía vibratoria hacia el entorno circundante y volver a lo que se llama el estado de singlete excitado más bajo. Desde el estado de singlete excitado más bajo, los electrones pueden «relajarse» retomando su estado fundamental con una emisión simultánea de luz fluorescente como se ilustra en la Figura 4(a). La luz emitida siempre presentará una longitud de onda más larga que la luz de excitación (Ley de Stokes) y se prolonga mientras la iluminación de excitación cubre la muestra fluorescente. Si la radiación excitante se detiene, la fluorescencia cesa.
Diagrama de energía de Jablonski
Explore cómo un electrón absorbe energía y trasciende a un estado de mayor energía en función de un diagrama de nivel de energía de Jablonski. Cuando un electrón se halla en el estado de excitación, éste se relaja lentamente a través de los efectos vibratorios para después volver al estado fundamental mediante la emisión de un fotón (fluorescencia).
En ocasiones, los electrones excitados, en lugar de relajarse al estado de singlete más bajo a través de las interacciones vibratorias, ejecutan una transición prohibida al estado de triplete y, después, al estado fundamental en un proceso en el que la emisión de radiación puede retrasarse considerablemente hasta varios segundos o más. Este fenómeno es característico de la fosforescencia, como se muestra en la Figura 4(b). En algunos casos, los electrones excitados pueden pasar del estado de triplete al estado de singlete excitado más bajo y, posteriormente, regresar al estado fundamental, al mismo tiempo que emiten la resultante luz fluorescente. Esta acción tarda un poco más (alrededor de uno o dos microsegundos) que la fluorescencia habitual y se denomina fluorescencia retardada [Figura 4(c)]. En otras circunstancias (p. ej., fotoblanqueo o presencia de sales de metales pesados u otros productos químicos), la luz emitida puede reducirse significativamente o detenerse por completo.
Desvanecimiento o fotoblanqueo
Existen condiciones específicas que pueden afectar la reradiación de luz a partir de un fluorocromo (o fluoróforo) excitado y, por lo tanto, reducir la intensidad de la fluorescencia. Esta reducción de la intensidad de emisión se denomina generalmente desvanecimiento o fotoblanqueo. Algunos autores subdividen el desvanecimiento en extinción y blanqueo. El blanqueo es la descomposición irreversible de las moléculas fluorescentes debido a la intensidad de la luz en presencia de oxígeno molecular. La extinción también es el resultado de una intensidad de fluorescencia reducida y se produce con frecuencia debido a la presencia de agentes oxidantes, sales de metales pesados o compuestos halógenos.
A menudo, la extinción resulta de la transferencia de energía a otras moléculas receptoras físicamente cercanas a los fluorocromos excitados; a este fenómeno, se le conoce como transferencia de energía por resonancia. Este particular fenómeno se ha convertido en la base de una técnica innovadora que mide distancias muy por debajo de la resolución lateral del microscopio óptico.
La aparición del blanqueo ha promovido una técnica, a la que se le conoce como FRAP o recuperación de fluorescencia tras fotoblanqueo. La FRAP usa el blanqueo por medio de exposiciones cortas de láser, lo que permite la observación posterior de la recuperación de la fluorescencia causada por la difusión de fluorocromos en la zona blanqueada.
Propiedades de los reactivos antidesvanecimiento populares
Tabla N.° 2
| Reactivo antidesvanecimiento | Comentarios |
|---|---|
| p-fenilendiamina | El reactivo más efectivo para FITC. También es eficaz para la rodamina. Debe determinarse al 0,1 % de p-fenilendiamina en glicerol/PBS para su uso. El reactivo se ennegrece cuando se expone a la luz, por lo que debe almacenarse en un lugar oscuro. El contacto con la piel es extremadamente peligroso. |
| DABCO (1,4-diazabicyclo-2,2,2-octano) | Muy eficaz para FITC. Aunque su efecto es ligeramente inferior al de la p-fenilendiamina, es más resistente a la luz y presenta un mayor nivel de seguridad. |
| Galato de n-propilo | El reactivo más efectivo para rodamina y también efectivo para FITC. Debe determinarse al 1 % de galato de propilo en glicerol/PBS para su uso. |
| Cisteamina (2-mercaptoetilamina) | Se usa para observar especímenes de ADN y cromosomas teñidos con ioduro de propidio, naranja de acridina o cromomisina A3. Debe determinarse a 0,1 m de cisteamina en Tris-EDTA. |
Para reducir el grado de desvanecimiento en algunas muestras, es recomendable usar un filtro de densidad neutra en la trayectoria de la luz antes de que la iluminación alcance el filtro de excitación; de esta manera, la intensidad de la luz de excitación disminuye. En otros casos, los efectos de desvanecimiento pueden reducirse al cambiar el pH del medio de montaje o usando agentes antiblanqueo (varios de los agentes más importantes se enumeran en la Tabla 2). En el procesamiento de imágenes digitales, la fotomicrografía o la simple observación visual, cambiar rápidamente el campo de visión también puede evitar los efectos de desvanecimiento.
Sorry, this page is not
available in your country.