Principes fondamentaux de l’excitation et de l’émission de fluorescence
Principes fondamentaux de l’excitation et de l’émission de fluorescence
Les fluorophores sont des substances chimiques photoréactives capables d’absorber l’énergie lumineuse à une longueur d’onde donnée et d’émettre cette lumière à une longueur d’onde supérieure. Cette capacité permet de les utiliser comme réactifs de détection lors de l’étude de cellules et de tissus. Par leurs nouvelles configurations électroniques, les fluorophores présentent des spectres uniques et des caractéristiques d’absorption (généralement similaires au spectre d’excitation) et d’émission. Ces spectres d’absorption et d’émission présentent une intensité relative de fluorescence, l’intensité relative étant généralement représentée sur l’axe des ordonnées et la longueur d’onde sur l’axe des abscisses. Pour un fluorophore donné, les fabricants indiquent la longueur d’onde pour la crête de l’intensité de la lumière d’excitation et la longueur d’onde pour la crête de l’intensité de la fluorescence émise. Il est important de comprendre l’origine de ces graphiques et de ces courbes représentant les spectres d’excitation et d’émission pour un fluorochrome donné.
Détermination du spectre d’émission d’un fluorophore
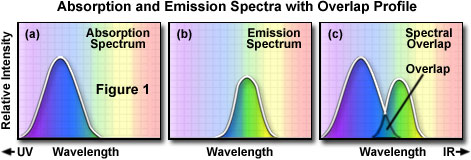
Pour déterminer le spectre d’émission d’un fluorophore, on détermine la longueur d’onde de l’absorption maximale (généralement la même que celle de l’excitation maximale) et on excite le fluorophore à cette longueur d’onde. Le spectre d’absorption d’un fluorophore est représenté dans la figure 1(a) ; l’intensité relative de l’absorption est représentée en fonction de la longueur d’onde mesurée. Un monochromateur (dispositif laissant passer des bandes étroites de longueurs d’onde) est ensuite utilisé pour scanner l’intensité de la fluorescence émise sur toute la série de longueurs d’onde d’émission. L’intensité relative de la fluorescence est mesurée aux différentes longueurs d’onde afin de tracer le spectre d’émission, comme illustré dans la figure 1(b). Le spectre d’excitation d’un fluorophore donné est déterminé de la même manière en mesurant la fluorescence émise à la longueur d’onde correspondant à l’intensité maximale lors de l’excitation du fluorophore par une série de longueurs d’onde consécutives. Le maximum d’émission est choisi et seule la lumière émise à la longueur d’onde correspondante peut passer jusqu’au détecteur. L’excitation est induite (généralement au moyen d’un monochromateur) à différentes longueurs d’onde d’excitation, et l’intensité de la fluorescence émise est mesurée en fonction de la longueur d’onde. Il en résulte un graphique ou une courbe (voir figure 1(a)) représentant l’intensité relative de la fluorescence produite par l’excitation sur tout le spectre de longueurs d’onde d’excitation.
Spectres des filtres de fluorescence
Explorez les zones de chevauchement des spectres d’excitation et d’émission de fluorescence de filtres dichromatiques et découvrez comment les changements des caractéristiques de transmission déterminent la largeur de bande des longueurs d’onde qui passent au travers différentes combinaisons de filtres.
Observations à tirer des spectres d’excitation et d’émission
Plusieurs observations peuvent être tirées d’un ensemble de courbes ou de spectres d’excitation et d’émission. Il y a généralement un chevauchement entre les longueurs d’onde de la fin du spectre d’excitation et celles du début du spectre d’émission. En microscopie de fluorescence, ce chevauchement des intensités et des longueurs d’onde d’excitation et d’émission (figure 1(c)) doit être éliminé par la sélection du filtre d’excitation, du diviseur de faisceaux (épifluorescence) et du filtre d’émission appropriés. Sinon, la lumière d’excitation beaucoup plus lumineuse couvre la lumière de fluorescence émise plus faible et réduit considérablement le contraste au niveau de l’échantillon.
Loi de Stokes
Lorsque les électrons passent de l’état excité à l’état fondamental, ceux-ci perdent de l’énergie de vibration (pour obtenir plus d’informations sur ce phénomène, consultez la section « Explications moléculaires de la fluorescence »). Étant donné que la longueur d’onde est inversement proportionnelle à l’énergie de rayonnement (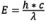 ), cette perte d’énergie décale le spectre d’émission vers des longueurs d’onde plus longues que celles du spectre d’excitation. Ce phénomène observé pour la première fois par Sir George G. Stokes au milieu du XIXe siècle est connu sous le nom de « loi de Stokes » ou de « déplacement de Stokes ». Plus le déplacement de Stokes est important, plus il est aisé de distinguer la lumière d’excitation de la lumière d’émission. Pour atteindre l’intensité de fluorescence maximale, le fluorophore est excité de manière optimale à la longueur d’onde d’excitation de crête, tandis que la détection de la lumière émise est sélectionnée à la longueur d’onde de crête (ou toute autre longueur d’onde choisie par l’observateur) de la courbe des émissions. La sélection des longueurs d’onde d’excitation et d’émission est contrôlée par des filtres adaptés capables d’empêcher certaines longueurs d’onde de passer. Lors de la détermination de la réponse spectrale de l’ensemble du système optique, des corrections techniques supplémentaires sont nécessaires pour prendre en compte des facteurs comme la transmission du verre et la sensibilité du détecteur qui varient pour différentes longueurs d’onde.
), cette perte d’énergie décale le spectre d’émission vers des longueurs d’onde plus longues que celles du spectre d’excitation. Ce phénomène observé pour la première fois par Sir George G. Stokes au milieu du XIXe siècle est connu sous le nom de « loi de Stokes » ou de « déplacement de Stokes ». Plus le déplacement de Stokes est important, plus il est aisé de distinguer la lumière d’excitation de la lumière d’émission. Pour atteindre l’intensité de fluorescence maximale, le fluorophore est excité de manière optimale à la longueur d’onde d’excitation de crête, tandis que la détection de la lumière émise est sélectionnée à la longueur d’onde de crête (ou toute autre longueur d’onde choisie par l’observateur) de la courbe des émissions. La sélection des longueurs d’onde d’excitation et d’émission est contrôlée par des filtres adaptés capables d’empêcher certaines longueurs d’onde de passer. Lors de la détermination de la réponse spectrale de l’ensemble du système optique, des corrections techniques supplémentaires sont nécessaires pour prendre en compte des facteurs comme la transmission du verre et la sensibilité du détecteur qui varient pour différentes longueurs d’onde.
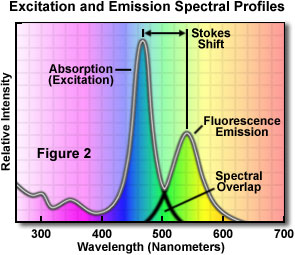
Un graphique des spectres d’absorption et d’émission d’un fluorophore typique est illustré dans la figure 2. Notez que les courbes de l’intensité de fluorescence pour l’absorption (généralement similaires à la courbe d’excitation des composés purs) et l’émission pour un tel fluorophore ont des formes plutôt similaires. Remarquez également que la fin de la courbe d’excitation chevauche le début de la courbe d’émission.
Cubes porte-filtres de fluorescence
Découvrez comment, en jouant sur la bande passante des filtres d’excitation et des filtres barrière, il est possible d’éclairer l’échantillon avec une bande de longueurs d’onde spécifiques et, ensuite, de ne laisser passer jusqu’au détecteur que certaines longueurs d’onde en excluant toutes les autres longueurs d’onde.
Séparation des longueurs d’onde d’excitation et d’émission
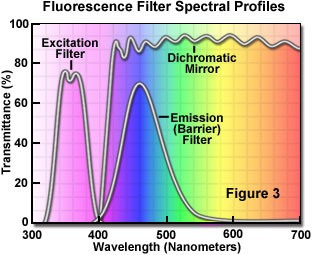
La séparation des longueurs d’onde d’excitation et d’émission est réalisée par l’utilisation de filtres permettant de bloquer ou de laisser passer des longueurs d’onde spécifiques du spectre comme illustré dans la figure 3. La conception des illuminateurs pour la fluorescence repose sur le contrôle de la lumière d’excitation et de la lumière d’émission par insertion de filtres amovibles dans le trajet optique conduisant la lumière à l’échantillon (excitation) et celui conduisant la lumière en provenance de l’échantillon (émission). Compte tenu de la faible intensité de la lumière émise, il est important de choisir une source de lumière d’excitation suffisamment lumineuse – de sorte à maximiser la lumière émise relativement faible – et des fluorophores ayant une absorption et un rendement satisfaisants.
L’efficacité avec laquelle le fluorophore absorbe la lumière d’excitation s’exprime par le coefficient d’extinction moléculaire. Plus le coefficient d’extinction moléculaire est élevé, plus la possibilité d’absorption de la lumière est grande sur une plage de longueurs d’onde donnée (prérequis pour l’émission de fluorescence résultante). Le rendement de la lumière émise est appelé « rendement quantique », c’est-à-dire le rapport entre le nombre de quantum (« paquets » d’énergie) émis et le nombre de quantum absorbés (de nombreux fluorophores commerciaux ont un rendement compris entre 0,1 et 0,9). Les rendements quantiques inférieurs à 1 sont dus à la perte d’énergie par des voies non radiatives, telles que la chaleur ou une réaction photochimique, plutôt que par la voie reradiative de fluorescence. Veuillez trouver dans le tableau 1 ci-dessous les rendements quantiques de fluorescence de certains fluorophores. Remarquez que certains rendements quantiques semblent mineurs (benzène) quand d’autres sont très élevés (fluorescéine et rhodamine B).
Rendements quantiques de fluorescence de fluorophores
Tableau 1
| Composé | Solvant | Longueur d’onde
d’excitation (nm) | Longueur d’onde
d’émission (nm) | Rendement quantique |
|---|---|---|---|---|
| Acridine orange | Éthanol | 493 | 535 | 0,46 |
| Benzène | Éthanol | 248 | 300-350 | 0,04 |
| Chlorophylle A | Éthanol | 440 | 685 | 0,23 |
| Éosine | Eau | 521 | 544 | 0,16 |
| Fluorescéine | Eau | 437 | 515 | 0,92 |
| Rhodamine B | Éthanol | 555 | 627 | 0,97 |
Le coefficient d’extinction moléculaire, le rendement quantique, l’intensité lumineuse moyenne (luminosité intrinsèque) de la source de lumière et la durée de vie de la fluorescence (durée de vie de l’état excité) sont tous des facteurs importants qui contribuent à l’intensité et à l’utilité des émissions de fluorescence. En outre, l’environnement local entourant le fluorophore joue un rôle essentiel dans la détermination des caractéristiques d’émission de fluorescence. Des variables telles que la viscosité du solvant, les concentrations ioniques, le pH et l’hydrophobie dans l’environnement peuvent avoir des effets importants sur l’intensité de fluorescence et la durée de vie de l’état excité.
Explications moléculaires de la fluorescence
L’activité de fluorescence peut être décrite par un diagramme de Jablonski (figure 4(a)). Avant toute excitation, la configuration électronique de la molécule est décrite comme étant en état fondamental. Lors de l’absorption d’un photon de la lumière d’excitation, les électrons peuvent passer à un niveau d’énergie plus élevé et un état vibrationnel excité en seulement quelques femtosecondes (10-15 secondes).
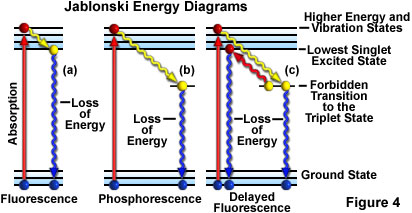
Pendant un intervalle d’environ un trillion de secondes (une picoseconde ou 10-12 secondes), les électrons excités peuvent perdre de l’énergie de vibration dans leurs environnements immédiats et revenir à ce qui est appelé l’état singulet excité le plus bas. Depuis cet état singulet excité le plus bas, les électrons sont ensuite capables de revenir à l’état fondamental avec une émission simultanée de lumière fluorescente, comme illustré dans la figure 4(a). La lumière émise est toujours d’une plus grande longueur d’onde que celle de la lumière d’excitation (loi de Stokes), et elle persiste tant que la lumière d’excitation éclaire l’échantillon fluorescent. Si le rayonnement d’excitation est interrompu, la fluorescence cesse.
Diagramme de Jablonski
Explorez comment un électron absorbe de l’énergie et transitionne vers un état énergétique plus élevé sur un diagramme de Jablonski. Une fois un électron en état excité, il subit une relaxation lente par effets vibrationnels, puis revient à l’état fondamental en émettant un photon (fluorescence).
Parfois, au lieu de subir une relaxation vers l’état singulet le plus par interactions vibrationnelles, les électrons excités font une transition interdite vers l’état triplet puis vers l’état fondamental dans un processus dans lequel l’émission du rayonnement peut être considérablement retardé de quelques secondes ou plus. Ce phénomène est caractéristique de la phosphorescence, comme illustré dans la figure 4(b). Dans certains cas, les électrons excités peuvent passer de l’état triplet à l’état singulet excité le plus bas puis revenir à l’état fondamental et émettre de la lumière fluorescente. Ce phénomène prend un peu plus de temps (environ une ou deux microsecondes) que la fluorescence habituelle et s’appelle « fluorescence retardée » (figure 4(c)). Dans d’autres circonstances (par exemple, en cas de photoblanchiment ou en présence de sels de métaux lourds ou d’autres produits chimiques), la lumière émise peut être significativement réduite ou complètement arrêtée.
Atténuation ou photoblanchiment
Certaines conditions peuvent affecter la réémission de la lumière par un fluorophore excité et, ainsi, réduire l’intensité de la fluorescence. Cette baisse de l’intensité de la lumière émise est généralement appelée « atténuation » ou « photoblanchiment ». Certains auteurs divisent l’atténuation en désactivation (quenching) et blanchiment. Le blanchiment constitue une décomposition irréversible des molécules fluorescentes due à l’intensité lumineuse en présence de molécules d’oxygène. La désactivation entraîne également une baisse de l’intensité de la fluorescence et est généralement due à des agents oxydants ou à la présence de sels de métaux lourds ou de composés halogénés.
Bien souvent, la désactivation est provoquée par le transfert d’énergie vers d’autres accepteurs physiquement proches des fluorophores excités, un phénomène appelé « transfert d’énergie par résonance ». Ce phénomène particulier constitue la base d’une toute nouvelle technique de mesure des distances très inférieures à la résolution latérale d’un microscope optique.
Quant au blanchiment, il a permis de mettre au point la technique de FRAP (Fluorescence Recovery After Photobleaching) ou redistribution de fluorescence après photoblanchiment. La FRAP permet de blanchir certaines zones par de courts flashs laser, ce qui permet ensuite d’observer la redistribution de la fluorescence résultant de la diffusion de fluorophores dans les zones blanchies.
Propriétés des principaux réactifs anti-atténuation
Tableau 2
| Réactif anti-atténuation | Commentaires |
|---|---|
| p-Phénylènediamine | Réactif le plus efficace pour le FITC. Également efficace pour la Rhodamine. Le p-phénylène-diamine doit être dilué à 0,1 % dans une solution de glycérol/tampon phosphate salin pour être utilisé. Le réactif noircit lorsqu’il est exposé à la lumière; il doit donc être conservé à l’abri de la lumière. Tout contact avec la peau est extrêmement dangereux. |
| DABCO (1,4-diazabicyclo[2.2.2]octane) | Très efficace pour le FITC. Bien que son action soit légèrement plus faible que celle du p-phénylènediamine, il est plus résistant à la lumière et présente un meilleur niveau de sécurité. |
| n-propylgallate | Le réactif le plus efficace pour la rhodamine, aussi efficace pour le FITC. Le n-propylgallate doit être dilué à 1 % dans une solution de glycérol/tampon phosphate salin pour être utilisé. |
| 2-mercaptoéthylamine | Utilisé pour observer les échantillons de chromosome et d’ADN marqués à l’iodure de propidium, à l’acridine orange ou à la chromomycine A3. Le 2-mercaptoéthylamine doit être dilué à 0,1 mM dans une solution tampon Tris-EDTA. |
Pour réduire le degré d’atténuation dans certains échantillons, il peut être envisageable d’utiliser un filtre de densité neutre dans le trajet optique avant le filtre d’excitation pour réduire l’intensité de la lumière d’excitation. En d’autres cas, les effets d’atténuation peuvent être réduits en modifiant le pH du milieu de montage ou en utilisant des agents antiblanchiment (une liste des principaux est donnée dans le tableau 2). Pour l’imagerie numérique, la photomicrographie ou l’observation visuelle, le changement rapide du champ de vision permet également d’éviter les effets d’atténuation.
Sorry, this page is not
available in your country.



