Princípios básicos de excitação e emissão de fluorescência
Princípios básicos de excitação e emissão de fluorescência
Os fluorocromos são compostos químicos fotorreativos que absorvem a energia da luz de um determinado comprimento de onda e emitem essa luz em um comprimento de onda maior. Essa capacidade faz deles reagentes úteis no estudo de células e tecidos. Por suas configurações eletrônicas originais, os fluorocromos têm espectros únicos e característicos para absorção (normalmente semelhantes aos da excitação) e emissão. Esses espectros de absorção e emissão mostram a intensidade relativa da fluorescência, com uma intensidade relativa normalmente representada no eixo vertical e com o comprimento de onda no eixo horizontal. Para um determinado fluorocromo, os fabricantes indicam o comprimento de onda para o pico de intensidade de excitação de iluminação e o comprimento de onda para o pico de intensidade de emissão de fluorescência. É importante compreender a origem desses gráficos e curvas que exibem os espectros de excitação e emissão para um determinado fluorocromo.
Como determinar o espectro de emissão de um fluorocromo
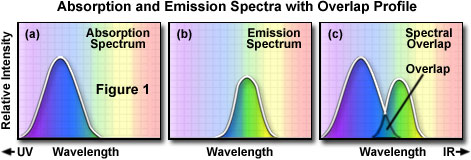
Para determinar o espectro de emissão de um fluorocromo específico, é determinado o comprimento de onda de absorção máxima (normalmente o mesmo que o máximo de excitação), e o fluorocromo é excitado nesse comprimento de onda. O espectro de absorção de um fluorocromo típico é ilustrado na figura 1(a), em que a intensidade relativa de absorção é traçada em relação ao comprimento de onda medido. Um monocromador (um dispositivo que permite a passagem de faixas estreitas de comprimentos de onda de luz) é usado para ler a intensidade de emissão da fluorescência em toda a série de comprimentos de onda de emissão. A intensidade relativa da fluorescência é medida em vários comprimentos de onda a fim de traçar o espectro da emissão, conforme ilustrado na figura 1(b). O espectro de excitação de um determinado fluorocromo é determinado de maneira semelhante monitorando a emissão de fluorescência no comprimento de onda de intensidade máxima enquanto o fluoróforo é excitado por meio de um grupo de comprimentos de onda consecutivos. O máximo de emissão é escolhido, e apenas a luz de emissão nesse comprimento de onda pode passar para o detector. A excitação é induzida (normalmente por meio de um monocromador) em vários comprimentos de onda de excitação, e a intensidade da fluorescência emitida é medida como uma função do comprimento. O resultado é um gráfico ou curva [ilustrado na figura 1(a)], que representa a intensidade da fluorescência relativa produzida pela excitação ao longo do espectro de comprimentos de onda de excitação.
Espectros de filtro de fluorescência
Conheça as regiões de sobreposição de excitação de fluorescência, emissão e perfis espectrais de filtros dicromáticos e como as alterações nas características de transmissão determinam a largura de banda dos comprimentos de onda que passam por várias combinações de filtros.
Observações de espectros de excitação e emissão
Várias observações podem ser feitas a partir de um conjunto típico de curvas ou espectros de excitação e emissão. Normalmente, há uma sobreposição entre a extremidade superior do comprimento de onda do espectro de excitação e a extremidade inferior do espectro de emissão.No microscópio fluorescente, essa sobreposição de intensidades e comprimentos de onda de excitação e emissão [figura 1(c)] deve ser eliminada selecionando o filtro de excitação, o divisor de feixe (fluorescência de luz refletida) e o filtro de emissão adequados. Caso contrário, a luz de excitação muito mais brilhante dominará a luz de fluorescência emitida mais fraca e diminuirá o contraste da amostra.
Lei de Stokes
Quando os elétrons passam do estado excitado para o estado fundamental, ocorre uma perda de energia vibracional (para obter mais informações sobre esse fenômeno, consulte Explicação molecular da fluorescência). Como o comprimento de onda é inversamente proporcional à energia da radiação (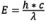 ), a perda de energia desloca o espectro de emissão para comprimentos de onda mais longos do que o espectro de excitação. Esse fenômeno é conhecido como Lei de Stokes ou Deslocamento de Stokes, pois foi descoberta por Sir George G. Stokes na metade do século 19. Quanto maior o deslocamento de Stokes, mais fácil é separar a luz de excitação da luz de emissão. Para alcançar a intensidade máxima da fluorescência, o fluorocromo é excitado do modo mais eficiente no comprimento de excitação de pico, e a detecção de emissão é selecionada no comprimento de onda de pico (ou outros comprimentos de onda escolhidos pelo observador) da curva de emissão. As seleções de comprimentos de onda de emissão são controladas por filtros adequados que restringem quais comprimentos de onda de luz podem passar. Ao determinar a resposta espectral de todo o sistema óptico, são necessárias correções técnicas adicionais para levar em consideração fatores como transmissão de vidro e sensibilidade do detector, que variam de acordo com o comprimento de onda.
), a perda de energia desloca o espectro de emissão para comprimentos de onda mais longos do que o espectro de excitação. Esse fenômeno é conhecido como Lei de Stokes ou Deslocamento de Stokes, pois foi descoberta por Sir George G. Stokes na metade do século 19. Quanto maior o deslocamento de Stokes, mais fácil é separar a luz de excitação da luz de emissão. Para alcançar a intensidade máxima da fluorescência, o fluorocromo é excitado do modo mais eficiente no comprimento de excitação de pico, e a detecção de emissão é selecionada no comprimento de onda de pico (ou outros comprimentos de onda escolhidos pelo observador) da curva de emissão. As seleções de comprimentos de onda de emissão são controladas por filtros adequados que restringem quais comprimentos de onda de luz podem passar. Ao determinar a resposta espectral de todo o sistema óptico, são necessárias correções técnicas adicionais para levar em consideração fatores como transmissão de vidro e sensibilidade do detector, que variam de acordo com o comprimento de onda.
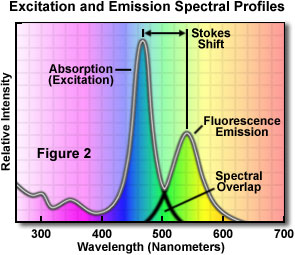
Um diagrama espectral de emissão-absorção do fluorocromo está ilustrado na figura 2. Observe que as curvas de intensidade de fluorescência para absorção (normalmente semelhantes à curva de excitação para compostos puros) e emissão desse fluorocromo típico são um pouco semelhantes em sua forma. Observe também que as curvas de excitação e emissão se sobrepõem levemente na extremidade superior da excitação e nos comprimentos de onda inferiores da curva de emissão.
Cubos do filtro de fluorescência
Veja como as variações na região do comprimento de onda da faixa de passagem dos filtros de excitação e barreira permitem que uma faixa específica de comprimentos de onda ilumine a amostra e, depois, passe pelo detector enquanto todas as outras são excluídas.
Separação de comprimentos de onda de excitação e emissão
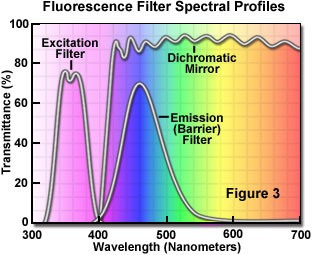
A separação dos comprimentos de onda de excitação e emissão é obtida pela seleção adequada de filtros para bloquear ou passar comprimentos de onda específicos do espectro, conforme representado na figura 3. O projeto dos iluminadores de fluorescência é baseado no controle da luz de excitação e da luz de emissão por inserções de filtro prontamente cambiáveis no caminho da luz, em direção à amostra (excitação) e, depois, emanando da amostra (emissão). Levando em conta as baixas intensidades de emissão, é importante que a fonte de luz escolhida para excitação tenha brilho suficiente para que uma luz de emissão relativamente fraca possa ser maximizada, e que fluorocromos de absorção e rendimento satisfatórios sejam escolhidos.
A eficiência com que o fluorocromo absorve a luz de excitação é conhecida como coeficiente de extinção molecular. Quanto maior o coeficiente de extinção molecular, maior a possibilidade de absorção da luz em uma determinada região do comprimento de onda (um pré-requisito para a emissão de fluorescência). O rendimento da luz emitida é conhecido como rendimento quântico, a razão entre o número de quanta (“pacotes” de energia) emitidos em comparação com o número de quanta absorvido (muitos fluorocromos comerciais têm rendimentos entre 0,1 e 0,9). Os rendimentos quânticos abaixo de 1 são o resultado da perda de energia por meios não radiativos, como calor ou uma reação fotoquímica, em vez da via rerradiativa da fluorescência. Na tabela 1 abaixo, estão listados os rendimentos quânticos de fluorescência de um grupo de fluorocromos selecionados. Observe que alguns rendimentos quânticos parecem triviais (benzeno), enquanto outros são muito eficientes (fluoresceína e rodamina-B).
Rendimentos quânticos de fluorescência do fluorocromo
Tabela 1
| Composto | Solvente | Excitação
Comprimento de onda (nm) | Emissão
Comprimento de onda (nm) | Rendimento quântico |
|---|---|---|---|---|
| Laranja de acridina | Etanol | 493 | 535 | 0,46 |
| Benzeno | Etanol | 248 | 300-350 | 0,04 |
| Clorofila A | Etanol | 440 | 685 | 0,23 |
| Eosina | Água | 521 | 544 | 0,16 |
| Fluoresceína | Água | 437 | 515 | 0,92 |
| Rodamina-B | Etanol | 555 | 627 | 0,97 |
Coeficiente de extinção molecular, rendimento quântico, intensidade luminosa média (brilho intrínseco) da fonte de luz e duração da fluorescência (duração do estado excitado) são fatores importantes que contribuem para a intensidade e a utilidade da emissão de fluorescência. Além disso, o ambiente ao redor do fluorocromo desempenha um papel fundamental na determinação das características da emissão de fluorescência. Variáveis como viscosidade do solvente, concentrações iônicas, pH e hidrofobicidade no ambiente podem ter efeitos profundos tanto na intensidade de fluorescência quanto na duração do estado excitado.
Explicação molecular da fluorescência
Outra maneira de descrever a atividade de fluorescência é usar um diagrama de Jablonski como o mostrado na figura 4(a).Antes da excitação, a configuração eletrônica da molécula é descrita como no estado fundamental. Ao absorver um fóton de luz de excitação, os elétrons podem ser elevados a uma energia mais alta e a um estado vibracional excitado em apenas alguns femtossegundos (10–15 segundos).
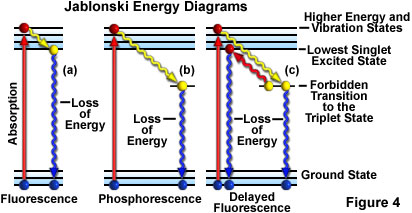
Durante um intervalo de aproximadamente um trilionésimo de segundo (um picossegundo ou 10-12 segundos), os elétrons excitados podem perder energia vibracional para o ambiente circundante e retornar ao que chamamos de estado excitado singleto mais baixo. A partir do estado excitado singleto mais baixo, os elétrons conseguem “relaxar” de volta ao estado fundamental com emissão simultânea de luz fluorescente, conforme ilustrado na figura 4(a). A luz emitida é sempre de comprimento de onda maior que o da luz de excitação (Lei de Stokes) e permanece enquanto a iluminação de excitação banha a amostra fluorescente. Se a radiação excitante é interrompida, a fluorescência cessa.
Diagrama de energia de Jablonski
Veja como um elétron absorve energia e transcende para um estado de energia mais alto de acordo com um diagrama de níveis de energia de Jablonski. Depois que o elétron está no estado excitado, ele lentamente relaxa por meio de efeitos vibracionais e pode, assim, retornar ao estado fundamental emitindo um fóton (fluorescência).
Algumas vezes, em vez de relaxar para o estado singleto mais baixo, os elétrons excitados fazem uma transição proibida para o estado tripleto e para o estado fundamental, em um processo em que a emissão da radiação pode atrasar em vários segundos ou mais. Esse fenômeno é característico da fosforescência, conforme mostrado na figura 4(b). Em alguns casos, os elétrons excitados podem ir do estado tripleto de volta ao estado excitado singleto mais baixo e, depois, retornar ao estado fundamental, emitindo luz fluorescente. Essa ação demora um pouco mais (cerca de um ou dois microssegundos) do que a fluorescência normal e é chamada de fluorescência atrasada [figura 4(c)]. Sob outras circunstâncias (por exemplo, fotobranqueamento ou presença de sais de metais pesados ou outros produtos químicos), a luz emitida pode ficar bastante reduzida ou ser totalmente interrompida.
Perda de cor ou fotodegradação
Existem condições específicas que podem afetar a rerradiação da luz por um fluoróforo excitado e, assim, reduzir a intensidade da fluorescência. Essa redução da intensidade de emissão é normalmente chamada de perda de cor ou fotobranqueamento. Alguns autores subdividem ainda mais a perda de cor em têmpera e branqueamento. O branqueamento é a decomposição irreversível das moléculas fluorescentes devido à intensidade da luz na presença de oxigênio molecular. A têmpera também resulta em intensidade de fluorescência reduzida e frequentemente é resultado de agentes oxidantes ou da presença de sais de metais pesados ou compostos de halogênio.
Normalmente, a têmpera é resultante da transferência de energia para outras moléculas tomadoras fisicamente próximas aos fluoróforos excitados, um fenômeno conhecido como transferência de energia. Esse fenômeno específico se tornou a base para uma nova técnica de medição de distâncias muito abaixo da resolução lateral do microscópio óptico.
A ocorrência de branqueamento levou a uma técnica conhecida como FRAP, ou recuperação de fluorescência após fotobranqueamento. A FRAP utiliza o branqueamento por meio de rajadas curtas de laser, permitindo a observação posterior da recuperação da fluorescência causada pela difusão de fluoróforos na área branqueada.
Propriedades de reagentes antidesbotamento conhecidos
Tabela 2
| Reagente antidesbotamento | Comentários |
|---|---|
| p-Fenilenodiamina | O reagente mais eficaz para FITC. Também eficaz para rodamina. Deve ser ajustado para 0,1% de p-Fenilenodiamina em glicerol/PBS para uso. O reagente escurece quando exposto à luz, por isso, deve ser armazenado em local escuro. O contato com a pele é extremamente perigoso. |
| DABCO (1,4-diazabi-ciclo[2,2,2]-octano) | Altamente eficaz para FITC. Embora o seu efeito seja ligeiramente inferior ao da p-Fenilenodiamina, é mais resistente à luz e apresenta um nível de segurança maior. |
| galato de n-propila | O reagente mais eficaz para rodamina, também eficaz para FITC. Deve ser ajustado para 1% de galato de propila em glicerol/PBS para uso. |
| 2-mercapto-etilamina | Usado para observar amostras de cromossomo e DNA coradas com iodeto de propídio, laranja de acridina ou cromomisina A3. Deve ser ajustado para 0,1 mM 2-mercaptoteilamina em Tris-EDTA |
Para reduzir o grau de perda de cor em algumas amostras, é aconselhável usar um filtro de densidade neutra no caminho da luz antes que a iluminação atinja o filtro de excitação para diminuir a intensidade da luz de excitação. Em outros casos, os efeitos da perda de cor podem ser reduzidos alterando o pH do meio de montagem ou usando agentes antibranqueamento (vários agentes importantes estão listados na tabela 2). Para imagens digitais, fotomicrografias ou observação visual, alterar rapidamente o campo de visão também pode evitar efeitos de perda de cor.
Sorry, this page is not
available in your country.