Grundlagen der Fluoreszenzanregung und -emission
Grundlagen der Fluoreszenzanregung und -emission
Fluorochrome sind photoreaktive chemische Verbindungen, die Lichtenergie einer bestimmten Wellenlänge absorbieren und dieses Licht bei einer längeren Wellenlänge emittieren. Diese Fähigkeit macht sie zu nützlichen Nachweisreagenzien bei der Untersuchung von Zellen und Gewebe. Aufgrund ihrer neuartigen elektronischen Konfigurationen haben Fluorochrome einzigartige und charakteristische Spektren für Absorption (in der Regel ähnlich der Anregung) und Emission. Diese Absorptions- und Emissionsspektren zeigen die relative Intensität der Fluoreszenz, wobei die relative Intensität klassischerweise auf der vertikalen Achse gegen die Wellenlänge auf der horizontalen Achse aufgetragen wird. Für ein bestimmtes Fluorochrom geben Hersteller die Wellenlänge für das Maximum der Beleuchtungsanregungsintensität und die Wellenlänge für das Maximum der Fluoreszenzemissionsintensität an. Es ist wichtig zu verstehen, wie diese Diagramme und Kurven, die die Anregungs- und Emissionsspektren für ein bestimmtes Fluorochrom darstellen, zustande kommen.
So wird das Emissionsspektrum eines Fluorochroms bestimmt
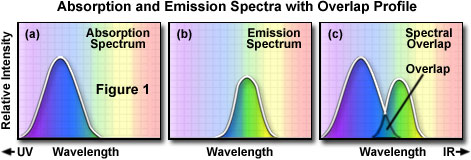
Zur Bestimmung des Emissionsspektrums eines bestimmten Fluorochroms wird die Wellenlänge des Absorptionsmaximums (in der Regel dasselbe wie das Anregungsmaximum) bestimmt und das Fluorochrom wird bei dieser Wellenlänge angeregt. Das Absorptionsspektrum eines typischen Fluorochroms ist in Abbildung 1(a) dargestellt. Darin ist die relative Intensität der Absorption gegen die gemessene Wellenlänge aufgetragen. Dann wird ein Monochromator (ein Gerät, das Schmalbänder von Lichtwellenlängen durchlässt) verwendet, um die Intensität der Fluoreszenzemission für alle Emissionswellenlängen abzutasten. Die relative Intensität der Fluoreszenz wird bei den verschiedenen Wellenlängen gemessen, um das Emissionsspektrum aufzuzeichnen (Abbildung 1(b)). Das Anregungsspektrum eines bestimmten Fluorochroms wird auf ähnliche Weise bestimmt. Die Fluoreszenzemission wird bei der Wellenlänge maximaler Intensität überwacht, während das Fluorophor durch eine Gruppe aufeinander folgender Wellenlängen angeregt wird. Das Emissionsmaximum wird gewählt und nur Emissionslicht dieser Wellenlänge wird zum Detektor durchgelassen. Die verschiedenen Anregungswellenlängen werden (üblicherweise mit einem Monochromator) angeregt und die Intensität der emittierten Fluoreszenz wird als Funktion der Wellenlänge gemessen. Das Ergebnis ist ein Diagramm oder eine Kurve (Abbildung 1(a)), die die durch die Anregung erzeugte relative Fluoreszenzintensität über das Spektrum der Anregungswellenlängen hinweg zeigt.
Fluoreszenzfilterspektren
Erfahren Sie mehr über die Überlappungsbereiche von Fluoreszenzanregungs-, Emissions- und dichromatischen Filterspektralprofilen und darüber, wie Veränderungen in den Übertragungseigenschaften die Bandbreite der Wellenlängen bestimmen, die verschiedene Filterkombinationen durchlaufen.
Betrachtungen von Anregungs- und Emissionsspektren
Anhand typischer Anregungs- und Emissionskurven oder -spektren können mehrere Betrachtungen erfolgen. In der Regel gibt es eine Überlappung zwischen dem höheren Wellenlängenende des Anregungsspektrums und dem niedrigeren Wellenlängenende des Emissionsspektrums.Bei der Fluoreszenzmikroskopie muss diese Überlappung von Anregungs- und Emissionsintensitäten und -wellenlängen (Abbildung 1(c)) durch die Wahl eines geeigneten Anregungsfilters, Strahlteilers (reflektiertes Fluoreszenzlicht) und Emissionsfilters beseitigt werden. Andernfalls überlappt das viel hellere Anregungslicht das schwächere emittierte Fluoreszenzlicht und verringert den Probenkontrast erheblich.
Gesetz von Stokes
Wenn Elektronen vom angeregten Zustand in den Grundzustand übergehen, geht Schwingungsenergie verloren (weitere Informationen zu diesem Phänomen finden Sie unter Molekulare Erklärung der Fluoreszenz). Da die Wellenlänge umgekehrt proportional zur Strahlungsenergie ist (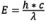 ), verschiebt der Energieverlust das Emissionsspektrum zu längeren Wellenlängen als die des Anregungsspektrums. Dieses Verschiebungsphänomen ist als Gesetz von Stokes bekannt, da es von Sir George G. Stokes Mitte des 19. Jh. formuliert wurde. Je größer die Verschiebung ist, desto einfacher ist es, Anregungslicht von Emissionslicht zu unterscheiden. Um eine maximale Fluoreszenzintensität zu erreichen, wird das Fluorochrom am Maximum der Anregungswellenlänge optimal angeregt, und die Emissionserkennung wird am Maximum der Wellenlänge (oder anderen vom Bediener gewählten Wellenlängen) der Emissionskurve gewählt. Die Auswahl der Anregungswellenlängen und der Emissionswellenlängen wird durch geeignete Filter gesteuert, die nur Licht bestimmter Wellenlängen durchlassen. Bei der Bestimmung der spektralen Empfindlichkeit des gesamten optischen Systems sind zusätzliche technische Korrekturen erforderlich, um Faktoren wie die Glastransmission und die Empfindlichkeit des Detektors zu berücksichtigen, die je nach Wellenlänge variieren.
), verschiebt der Energieverlust das Emissionsspektrum zu längeren Wellenlängen als die des Anregungsspektrums. Dieses Verschiebungsphänomen ist als Gesetz von Stokes bekannt, da es von Sir George G. Stokes Mitte des 19. Jh. formuliert wurde. Je größer die Verschiebung ist, desto einfacher ist es, Anregungslicht von Emissionslicht zu unterscheiden. Um eine maximale Fluoreszenzintensität zu erreichen, wird das Fluorochrom am Maximum der Anregungswellenlänge optimal angeregt, und die Emissionserkennung wird am Maximum der Wellenlänge (oder anderen vom Bediener gewählten Wellenlängen) der Emissionskurve gewählt. Die Auswahl der Anregungswellenlängen und der Emissionswellenlängen wird durch geeignete Filter gesteuert, die nur Licht bestimmter Wellenlängen durchlassen. Bei der Bestimmung der spektralen Empfindlichkeit des gesamten optischen Systems sind zusätzliche technische Korrekturen erforderlich, um Faktoren wie die Glastransmission und die Empfindlichkeit des Detektors zu berücksichtigen, die je nach Wellenlänge variieren.
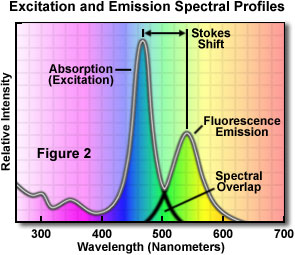
Ein typisches Fluorochrom-Absorptions-/Emissions-Spektraldiagramm ist in Abbildung 2 dargestellt. Es ist zu beachten, dass die Kurven der Fluoreszenzintensität für Absorption (normalerweise ähnlich der Anregungskurve für reine Verbindungen) und Emission für dieses typische Fluorochrom eine recht ähnliche Form haben. Ferner ist zu beachten, dass sich die Anregungs- und Emissionskurve am oberen Ende der Anregungs- und an den unteren Wellenlängen der Emissionskurve etwas überlappen.
Fluoreszenz-Filterwürfel
Erfahren Sie mehr darüber, wie Variationen im Bandpass-Wellenlängenbereich von Anregungs- und Sperrfiltern es ermöglichen, dass ein bestimmtes Wellenlängenband die Probe beleuchtet und dann bis zum Detektor gelangt, während alle anderen ausgeschlossen werden.
Die Trennung von Anregungs- und Emissionswellenlängen
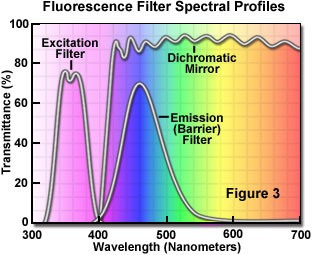
Die Trennung von Anregungs- und Emissionswellenlängen wird durch die richtige Filterauswahl erreicht, die bestimmte Wellenlängen des Spektrums blockieren oder durchlassen (Abbildung 3). Die Konstruktion der Fluoreszenzbeleuchtung basiert auf der Steuerung des Anregungslichts und des Emissionslichts durch leicht auswechselbare Filtereinsätze für den Lichtweg zur Probe (Anregung) und anschließend weg von der Probe (Emission). Angesichts der geringen Emissionsintensitäten ist es wichtig, dass die für die Anregung gewählte Lichtquelle eine ausreichende Helligkeit aufweist, damit das relativ schwache Emissionslicht optimal genutzt werden kann, und dass Fluorochrome mit ausreichender Absorption und Ausbeute gewählt werden.
Die Effizienz, mit der das Fluorochrom das Anregungslicht absorbiert, wird als molekularer Extinktionskoeffizient bezeichnet. Je größer der molekulare Extinktionskoeffizient, desto größer ist auch die Möglichkeit der Lichtabsorption in einem bestimmten Wellenlängenbereich (eine Voraussetzung für die anschließende Fluoreszenzemission). Die Ausbeute des emittierten Lichts wird als Quantenausbeute bezeichnet, d. h. das Verhältnis zwischen der Anzahl emittierter Quanten („Energiepakete“) und der Anzahl absorbierter Quanten (bei vielen gängigen Fluorochromen liegt die Ausbeute zwischen 0,1 und 0,9). Quantenausbeuten unter 1 sind das Ergebnis eines strahlungsfreien Energieverlustes, zum Beispiel durch Wärme oder eine photochemische Reaktion, und nicht durch die Rückstrahlung von Fluoreszenz. In Tabelle 1 unten sind Fluoreszenzquantenausbeuten für eine Gruppe ausgewählter Fluorochrome aufgeführt. Beachten Sie, dass einige Quantenausbeuten unbedeutend erscheinen (Benzol), während andere sehr effizient sind (Fluorescein und Rhodamin-B).
Fluorochrom-Fluoreszenz-Quantenausbeute
Tabelle 1
| Chemische Verbindung | Lösungsmittel | Anregung
Wellenlänge (nm) | Emission
Wellenlänge (nm) | Quantenausbeute |
|---|---|---|---|---|
| Acridinorange | Ethanol | 493 | 535 | 0,46 |
| Benzol | Ethanol | 248 | 300-350 | 0,04 |
| Chlorophyll-A | Ethanol | 440 | 685 | 0,23 |
| Eosin | Wasser | 521 | 544 | 0,16 |
| Fluorescein | Wasser | 437 | 515 | 0,92 |
| Rhodamin-B | Ethanol | 555 | 627 | 0,97 |
Der molekulare Extinktionskoeffizient, die Quantenausbeute, die mittlere Lichtstärke (intrinsische Helligkeit) der Lichtquelle und die Fluoreszenzlebensdauer (Dauer des angeregten Zustands) sind wichtige Faktoren, die zur Intensität und Nutzbarkeit der Fluoreszenzemission beitragen. Zudem spielt die lokalisierte Umgebung, die das Fluorochrom umgibt, eine wichtige Rolle bei der Bestimmung der Eigenschaften der Fluoreszenzemission. Verschiedene Variablen, wie zum Beispiel die Viskosität des Lösungsmittels, die Ionenkonzentration, der pH-Wert und die Hydrophobie der Umgebung, können tiefgreifende Auswirkungen auf die Fluoreszenzintensität und die Dauer des angeregten Zustands haben.
Molekulare Erklärung der Fluoreszenz
Eine andere Möglichkeit zur Darstellung der Fluoreszenzaktivität ist die Verwendung eines Jablonski-Diagramms (Abbildung 4(a)). Vor der Anregung befindet sich die elektronische Konfiguration des Moleküls im Grundzustand. Nach der Absorption eines Photons des Anregungslichts können die Elektronen innerhalb weniger Femtosekunden (10-15 Sekunden) in einen Zustand höherer Energie und angeregter Schwingungen versetzt werden.
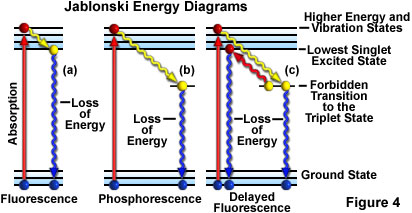
Während eines Intervalls von etwa einem Billionstel einer Sekunde (eine Pikosekunde bzw. 10-12 Sekunden) können die angeregten Elektronen etwas Schwingungsenergie an die Umgebung verlieren und in den niedrigsten angeregten Singulett-Zustand zurückkehren. Vom niedrigsten angeregten Singulett-Zustand können die Elektronen dann unter gleichzeitiger Emission von Fluoreszenzlicht zurück in den Grundzustand fallen (Abbildung 4(a)). Das emittierte Licht hat immer eine größere Wellenlänge als das Anregungslicht (Gesetz von Stokes) und dauert so lange an, wie das Anregungslicht die fluoreszierende Probe beleuchtet. Wenn die anregende Strahlung unterbrochen wird, hört die Fluoreszenz auf.
Jablonski-Energiediagramm
Sehen Sie, wie ein Elektron Energie absorbiert und gemäß einem Jablonski-Energiestufen-Diagramm in einen höheren Energiezustand übergeht. Sobald sich ein Elektron im angeregten Zustand befindet, beruhigt es sich langsam durch Schwingungseffekte und kann dann durch Aussendung eines Photons (Fluoreszenz) in den Grundzustand zurückfallen.
Gelegentlich kommt es vor, dass die angeregten Elektronen, anstatt durch Schwingungswechselwirkungen wieder in den niedrigsten Singulett-Zustand überzugehen, einen unerwünschten Übergang in den angeregten Triplett-Zustand und dann in den Grundzustand vollziehen, wobei die Emission von Strahlung bis zu mehreren Sekunden oder mehr erheblich verzögert sein kann. Dieses Phänomen ist typisch für Phosphoreszenz (Abbildung 4(b)). In einigen Fällen können die angeregten Elektronen vom Triplett-Zustand in den niedrigsten angeregten Singulett-Zustand übergehen und dann in den Grundzustand zurückfallen, wobei sie dann Fluoreszenzlicht aussenden. Dieser Vorgang dauert etwas länger (ca. ein oder zwei Mikrosekunden) als die übliche Fluoreszenz und wird als verzögerte Fluoreszenz bezeichnet (Abbildung 4(c)). Unter anderen Umständen (z. B. bei Photobleichung oder Vorhandensein von Salzen von Schwermetallen oder anderen Chemikalien) kann das emittierte Licht erheblich reduziert oder ganz unterbrochen werden.
Verblassen oder Photobleaching
Unter bestimmten Bedingungen kann die Rückstrahlung von Licht durch ein angeregtes Fluorophor beeinträchtigt und somit die Intensität der Fluoreszenz verringert werden. Diese Verringerung der Emissionsintensität wird allgemein als Verblassen oder Photobleaching bezeichnet. Einige Autoren unterscheiden weiter zwischen Quenching und Bleaching. Bleaching ist eine irreversible Zersetzung der fluoreszierenden Moleküle aufgrund der Lichtintensität bei vorhandenem molekularem Sauerstoff. Quenching führt ebenfalls zu einer verminderten Fluoreszenzintensität und wird häufig durch Oxidationsmittel oder vorhandenen Salzen von Schwermetallen oder Halogenverbindungen hervorgerufen.
Häufig resultiert das Quenching aus der Übertragung von Energie auf andere Akzeptormoleküle, die physikalisch nahe an den angeregten Fluorophoren sind, ein Phänomen, das als Resonanzenergietransfer bezeichnet wird. Dieses besondere Phänomen ist die Grundlage für eine neuere Technik zur Messung von Abständen, die weit unter der lateralen Auflösung des Lichtmikroskops liegen.
Bleaching hat zu einer Technik geführt, die als FRAP (Fluorescence Recovery After Photobleaching) bekannt ist. Beim FRAP findet das Bleaching durch kurze Laserimpulse statt, was die anschließende Betrachtung der Wiederherstellung der Fluoreszenz, die durch die Diffusion von Fluorophoren in den gebleichten Bereich verursacht wird, ermöglicht.
Eigenschaften gängiger Antifade-Reagenzien
Tabelle 2
| Antifade-Reagenz | Beschreibung |
|---|---|
| p-Phenylendiamin | Das wirksamste Reagenz für FITC. Auch effektiv für Rhodamin. Sollte in einer Konzentration von 0,1 % p-Phenylendiamin in Glycerin/PBS verwendet werden. Das Reagenz wird unter Lichteinwirkung schwarz, daher sollte es an einem dunklen Ort aufbewahrt werden. Hautkontakt ist äußerst gefährlich. |
| DABCO (1,4-Diazabicyclo-2,2,2-octan) | Sehr effektiv für FITC. Zwar ist seine Wirkung etwas geringer als die von p-Phenylendiamin, dafür ist es aber lichtbeständiger und sicherer. |
| n-Propylgallat | Das effektivste Reagenz für Rhodamin, auch effektiv für FITC. Sollte in einer Konzentration von 1 % Propylgallat in Glycerin/PBS verwendet werden. |
| 2-Mercaptoethylamin | Zur Betrachtung von Chromosomen- und DNA-Proben, die mit Propidiumjodid, Acridinorange oder Chromomysin A3 gefärbt wurden. Sollte in einer Konzentration von 0,1 mM 2-Mercaptotheylamin in Tris-EDTA verwendet werden |
Um das Ausmaß des Verblassens bei einigen Proben zu verringern, empfiehlt es sich, einen Neutraldichtefilter im Strahlengang zu verwenden, bevor das Beleuchtungslicht den Anregungsfilter erreicht, wodurch die Intensität des Anregungslichts verringert wird. In anderen Fällen können die Verblassungseffekte durch eine Änderung des pH-Werts des Mediums oder durch die Verwendung von Bleichschutzmitteln (einige der wichtigsten Mittel sind in Tabelle 2 aufgeführt) verringert werden. Bei der digitalen Bildgebung, der Mikrofotografie oder einfach bei der visuellen Betrachtung kann auch ein schneller Wechsel des Sichtfelds Verblassungseffekte vermeiden.
Sorry, this page is not
available in your country.