蛍光の励起と発光の原理
蛍光の励起と発光の原理
蛍光色素は光に反応する化合物で、特定の波長の光エネルギーを吸収し、そのエネルギーをより長い波長の光として発光します。この性質は、細胞や組織の研究で検出試薬として利用できるため便利です。蛍光色素は電子配置が独特なことから、吸収と発光のスペクトルが特徴的です。吸収と発光のスペクトルは蛍光の相対強度を示します。グラフでは慣行的に相対強度を縦軸に、波長を横軸に取ります。特定の蛍光色素について、励起および発光スペクトルのピーク波長で議論されることがよくありますが、グラフの意味を知り、蛍光色素の励起スペクトルと発光スペクトルを表す曲線を理解することが重要です。
蛍光色素の発光スペクトルの判別方法
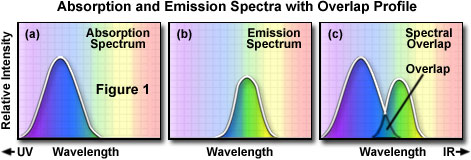
特定の蛍光色素の発光スペクトルを特定の蛍光色素の発光スペクトルを得るには、吸収のピーク波長を特定し、その波長で蛍光色素を励起する必要があります。。典型的な蛍光色素の吸収スペクトルを図1(a)に示します。図では、吸収の相対強度が、測定された波長に対してプロットされています。次にモノクロメーター(通過する光の波長の帯域を狭められる装置)を使用して、発光波長全体にわたる蛍光強度を測定することで、図1(b)に示すような発光スペクトルが得られます。特定の蛍光色素の励起スペクトルも励起波長を変えながら、蛍光のピーク波長での蛍光強度を測定することで同様に得ることができます。結果は励起波長域の光で励起された際の相対的な蛍光強度として図1(a)に示すようなグラフとなります。
励起スペクトルと蛍光スペクトルの観察
励起及び蛍光スペクトルを参考に、観察条件を決定します。励起スペクトルの長波長側と、蛍光スペクトルの短波長側には、通常重なりがあります。蛍光顕微鏡では、励起フィルター、ビームスプリッター(落射蛍光の場合)、および蛍光フィルターを適切に選択することによって、この励起及び蛍光スペクトルの重なり(図1(c))をなくすことが重要です。重なりがある場合は、蛍光に対して非常に強い励起光が検出器に入り、蛍光画像のコントラストが著しく低下してしまいます。
ストークスの法則
電子が励起状態から基底状態に移行するときには、振動エネルギーの損失があります(この現象については、「蛍光の分子的解釈」を参照してください)。波長は放射エネルギーに反比例するため(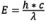 )、エネルギー損失によって蛍光スペクトルの波長は励起スペクトルより長くなります。この現象は、ジョージ・G・ストークスが19世紀半ばに発見したことから、ストークスの法則またはストークスシフトとして知られています。ストークスシフトが大きくなるほど、励起光と蛍光を区別しやすくなります。蛍光強度を最大にするには、蛍光色素を励起のピーク波長で適切に励起して、蛍光曲線のピーク波長(または観察者が選んだその他の波長)を選択して観察します。励起波長と発光波長の選択は、どの波長の光を通過させるかを制限する適切なフィルターによって制御されます。光学系全体の分光感度特性を求める場合、ガラスの透過率や検出器の感度など、波長によって異なる要素を考慮した技術的な補正が必要となります。
)、エネルギー損失によって蛍光スペクトルの波長は励起スペクトルより長くなります。この現象は、ジョージ・G・ストークスが19世紀半ばに発見したことから、ストークスの法則またはストークスシフトとして知られています。ストークスシフトが大きくなるほど、励起光と蛍光を区別しやすくなります。蛍光強度を最大にするには、蛍光色素を励起のピーク波長で適切に励起して、蛍光曲線のピーク波長(または観察者が選んだその他の波長)を選択して観察します。励起波長と発光波長の選択は、どの波長の光を通過させるかを制限する適切なフィルターによって制御されます。光学系全体の分光感度特性を求める場合、ガラスの透過率や検出器の感度など、波長によって異なる要素を考慮した技術的な補正が必要となります。
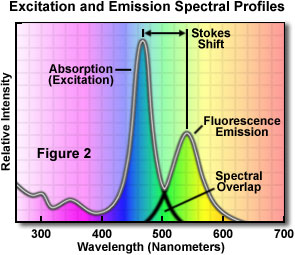
典型的な蛍光色素の吸収・蛍光スペクトルを図2に示します。この典型的な蛍光色素の吸収と蛍光のスペクトルは、形状がやや似ているのがわかります。励起スペクトルの長波長側と蛍光スペクトルの短波長側が、いくらか重なっていることにも注目してください。
蛍光フィルターキューブ
励起フィルターとバリアフィルターのバンドパス波長領域の変動によって、特定の波長域の光のみが標本に照射され、また別の特定の波長域の光のみが検出器へ届く様子を見てみましょう。
励起波長と蛍光波長の分離
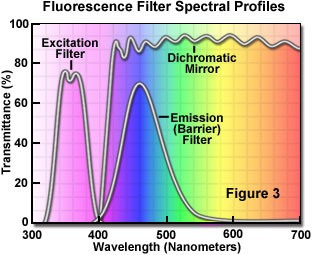
励起波長と蛍光波長を分離するには、図3に示すように、スペクトルの特定の波長をブロックまたは通過させる適切なフィルターを選択します。蛍光照明の設計の基本となるのは、標本への照明光路(励起)と標本からの検出光路(蛍光)の途中に、変更可能なフィルターを挿入することによって、励起光と蛍光をコントロールすることです。蛍光は強度が相対的に低いため、励起用光源は蛍光を最大化できる十分な明るさのものを選び、吸収効率と発光効率が十分な蛍光色素を選ぶことが重要です。
蛍光色素が励起光を吸収する効率は、分子吸光係数として知られています。分子吸光係数が大きいほど、特定の波長領域における光の吸収力は大きくなります(蛍光発光の前提条件)。放出される光の収率は量子収率と呼ばれ、吸収される量子数に対する放出される量子数(エネルギーの「パケット数」)の比を表します(市販の蛍光色素の多くは0.1~0.9の収率)。1より小さい量子収率は、蛍光の再放射経路ではなく、熱や光化学反応のような非放射経路でエネルギーが失われた結果です。下の表1に示すのは、選択した蛍光色素群に対する蛍光量子収率です。量子収率がわずかなもの(ベンゼン)もあれば、非常に効率的なもの(フルオレセインとローダミンB)もあります。
蛍光色素の蛍光量子収率
表1
| 化合物 | 溶剤 | 励起
波長 (nm) | 発光
波長 (nm) | 量子収率 |
|---|---|---|---|---|
| アクリジンオレンジ | エタノール | 493 | 535 | 0.46 |
| ベンゼン | エタノール | 248 | 300-350 | 0.04 |
| クロロフィルA | エタノール | 440 | 685 | 0.23 |
| エオシン | 水 | 521 | 544 | 0.16 |
| フルオレセイン | 水 | 437 | 515 | 0.92 |
| ローダミンB | エタノール | 555 | 627 | 0.97 |
分子吸光係数、量子収率、光源の平均光度(固有輝度)、蛍光寿命(励起状態期間)は、どれも蛍光発光の強度と有用性に寄与する重要な要素です。また、蛍光色素を取りまく環境は、蛍光発光の特性を決定する重要な役割を果たします。環境内の溶媒粘度、イオン濃度、pH、疎水性などの環境変数、蛍光強度と蛍光寿命のどちらにも大きな影響を及ぼす可能性があります。
蛍光の分子的解釈
蛍光作用を表すために用いられるもう一つの方法は、図4(a)に示すようなヤブロンスキー図です。励起状態になる前の分子の電子配置は基底状態といいます。励起光の光子を吸収する際、電子は高いエネルギーへと引き上げられ、数フェムト秒(10-15秒)で振動励起状態になります。
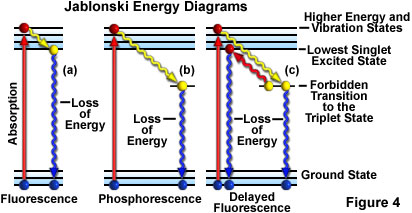
約1兆分の1秒(ピコ秒、10-12秒)の間、励起状態の電子は周囲環境によって一部の振動エネルギーを失い、いわゆる励起一重項状態に戻ります。励起一重項状態から、電子は光の放出を伴って安定した基底状態に戻ります(図4(a)参照)。放出される光は、必ず励起光よりも長波長であり(ストークスの法則)、励起光が蛍光試料を照らす間、持続します。励起光の照射が止まると、蛍光は停止します。
ヤブロンスキーのエネルギー図
電子がエネルギーを吸収し、高いエネルギー状態に遷移する様子を、ヤブロンスキーのエネルギーレベル図に沿って見てみましょう。電子は励起状態になると、振動作用を経て徐々に安定し、光子(蛍光)を放出することで基底状態へと戻ります。
時折、励起状態の電子が振動相互作用を経て一重項状態になる代わりに、励起三重項状態へと禁制遷移した後、基底状態に戻ることがあります。放射光の放出は最大数秒以上と大幅に遅れます。この現象はリン光の特徴です(図4(b)参照)。励起状態の電子が三重項状態から励起一重項状態に戻った後、基底状態に移り、続いて蛍光を放出する場合があります。この現象には通常の蛍光より少し時間がかかり(約1~2マイクロ秒)、遅延蛍光と呼ばれます(図4(c)参照)。その他の条件下では(例えば、退褪色、重金属塩など化学物質の存在)、放出される光が著しく低減したり、完全に停止したりする場合があります。
褪色
励起状態の蛍光色素による光の再放射に影響を及ぼし、蛍光強度を低下させる特殊な状態があります。発光強度の低下は、一般に褪色と呼ばれます。一部の論文では、消光と褪色に細分化されることもあります。褪色は、酸素分子存在下での光の照射により、蛍光分子が不可逆的に分解された状態です。消光も蛍光強度が低下して起こる状態で、多くの場合、酸化剤によるものか、重金属塩やハロゲン化合物の存在が原因です。
よくあるのは、励起した蛍光色素の物理的に近くにある他の受容体分子にエネルギーが移動して消光に至る、共鳴エネルギー移動として知られる現象です。この特殊な現象は、光学顕微鏡の横分解能をはるかに上回る距離を測定する、新しい技法のベースになっています。
褪色の発生は、FRAP(光退褪色後蛍光回復法)として知られる技法につながりました。FRAPは短時間のレーザー照射による褪色を利用するもので、褪色した部分に蛍光色素が拡散して蛍光が回復する様子を観察することができます。
よく使用される褪色防止剤の性質
表2
| 褪色防止剤 | コメント |
|---|---|
| p-フェニレンジアミン | FITCに最も効果のある試薬。ローダミンにも有効。使用の際はグリセロール/PBSで0.1%のp-フェニレンジアミンに調製する必要があります。露光により黒変するため、暗い場所に保管してください。肌に触れると極めて危険です。 |
| DABCO (1,4-ジアザビシクロ[2.2.2]オクタン) | FITCに高い効果があります。p-フェニレンジアミンと比べると効果はやや劣りますが、光耐性が強く、安全性が高いという特長があります。 |
| 没食子酸n-プロピル | ローダミンに最も効果的で、FITCにも有効です。使用の際は、グリセロール/PBSで1%の没食子酸プロピルに調製する必要があります。 |
| 2-メルカプトエチルアミン | ヨウ化プロピジウム、アクリジンオレンジ、クロモマイシンA3で染色した染色体とDNA試料の観察に使用します。トリス-EDTAで0.1mMの2-メルカプトエチルアミンに調製する必要があります。 |
試料によっては、励起フィルターの前の光路にNDフィルターを使用し、励起光強度を抑えることで褪色の程度を軽減することが望ましい場合があります。他の例では、褪色を抑えるために封入剤のpHを変えたり、褪色防止剤(表2)を使用したりします。デジタルイメージング、あるいは簡易な目視観察では、視野をすばやく変えることでも褪色を回避できます。
このページはお住まいの地域ではご覧いただくことはできません。