Importance de la clarification des tissus et du choix de l’objectif pour l’analyse 3D des sphéroïdes
Résumé
Les modèles tridimensionnels (3D), tels que les sphéroïdes ou les organoïdes, étant épais et opaques à cause de la diffusion de la lumière, il est difficile d’en faire des images en profondeur sans en altérer la morphologie. Heureusement, les techniques de clarification des tissus permettent d’acquérir des images de ces échantillons en profondeur en contrôlant les différents indices de réfraction (IR) des différents compartiments cellulaires.
Dans cette note d’application, nous allons présenter un protocole de clarification des sphéroïdes en une étape à l’aide du réactif de clarification des tissus SCALEVIEW-S4 et expliquer l’importance de rapprocher l’IR des sphéroïdes clarifiés avec celui de l’objectif.
Introduction
Les modèles 3D tels que les sphéroïdes et les organoïdes sont très utilisés, car, contrairement aux modèles monocouches 2D classiques, ils permettent de restituer au mieux le microenvironnement tel qu’il existe in vivo. Il est cependant difficile de prendre des images des plans profonds des modèles 3D épais à cause de la diffusion de la lumière provoquée par les compartiments cellulaires tels que les membranes lipidiques ou les structures renfermant des pigments.
Aujourd’hui, de nombreuses techniques de clarification optique des tissus (1, 2) permettent de rendre les sphéroïdes ou les organoïdes transparents. Il existe trois catégories principales de techniques de clarification : les techniques à base de solvant, les techniques à base d’eau et les techniques d’inclusion dans un hydrogel. Le SCALEVIEW-S, un réactif de clarification aqueux, entraîne rarement des modifications morphologiques dans les échantillons clarifiés (3).
Dans cette note d’application, nous nous intéressons à la méthode de clarification des sphéroïdes à l’aide du réactif SCALEVIEW-S4. Étant donné que les échantillons 3D transparents ont tendance à avoir un indice de réfraction élevé, nous décrivons également dans cette note les effets liés au manque d’homogénéité des indices de réfraction en comparant des images acquises à l’aide d’un objectif à sec (IR : 1,0), d’un objectif à immersion dans l’eau (IR : 1,33) et d’un objectif à immersion dans l’huile de silicone (IR : 1,4).
Matériel et méthodes
Préparation des échantillons
Du milieu de culture a été ensemencé avec des cellules d’adénocarcinome colorectal humain (lignée HT-29) dans une microplaque à 384 puits à fond en U, et les cellules ont été cultivée jusqu’à ce qu’elles forment des sphéroïdes d’un diamètre de 300 µm. Les sphéroïdes ont été fixés au paraformaldéhyde (PFA) à 4 % à 4 °C (39,2 °F) pendant une nuit et ont été marqués au DAPI dans du PBS (-).
Méthode de clarification
Les réactifs SCALEVIEW-S0, S1, S2, S3, S4 ainsi que la solution de rétraction ont été achetés (FUJIFILM Wako Chemicals) ou fabriqués (3). Le protocole original utilisant ces réactifs est décrit dans le tableau 1.
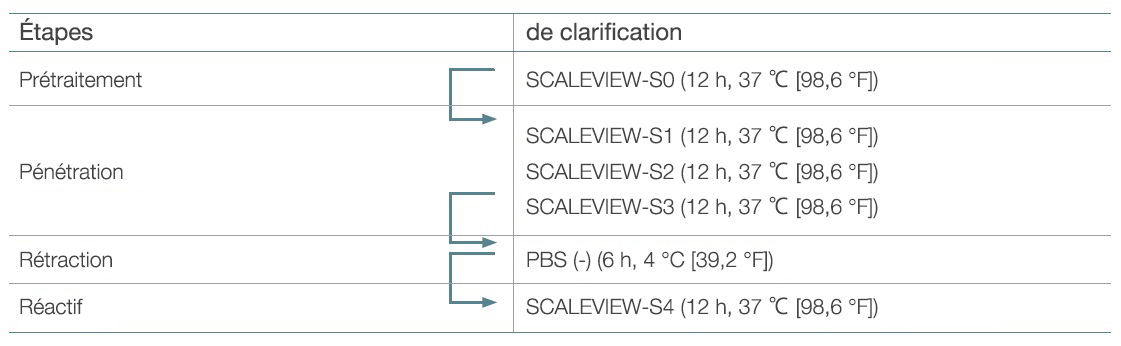
Tableau 1. Protocole SCALEVIEW-S original
Méthode d’imagerie
Nous avons acquis des images des sphéroïdes de cellules HT-29 marqués au DAPI avec ou sans clarification à l’aide de notre microscope confocal à balayage laser FLUOVIEW FV3000 et de trois objectifs décrits ci-dessus.
Résultats et discussion
Protocole de clarification de sphéroïdes en une étape à l’aide du réactif SCALEVIEW-S4
Le protocole SCALEVIEW-S original implique la substitution séquentielle de six réactifs différents (S0 - S4, solution de rétraction). L’échantillon se dilate et se rétracte pendant le traitement avec les réactifs S0 à S3 et la solution de rétraction, ce qui permet au réactif S4 de clarifier les tissus et de faire revenir l’échantillon à pratiquement 100 % de son volume initial.
Le protocole original étant optimisé pour la clarification des cerveaux de souris entiers, il faut incuber l’échantillon pendant près de 12 heures avec chacun des réactifs pour le clarifier. Étant donné que les sphéroïdes sont bien plus minces (200 à 300 µm) qu’un cerveau de souris, ils peuvent être clarifiés avec une incubation de seulement une heure dans le réactif S4 avec une légère agitation, après avoir été fixés et marqués.
Le sphéroïde clarifié par le réactif S4 et le sphéroïde clarifié selon le protocole original ont tous les deux conservé leur morphologie, comme illustré dans la figure 1a ci-dessous. L’intensité de la fluorescence de chaque sphéroïde clarifié pour chaque plan Z est représentée dans le graphique de la figure 1 b. Les résultats montrent de manière quantitative que le sphéroïde peut être clarifié uniquement à l’aide du réactif S4. Cela signifie que les petits modèles 3D tels que les sphéroïdes ou les organoïdes peuvent être facilement clarifiés à l’aide d’un protocole en une étape de réactif S4 après avoir été fixés et marqués, ce qui permet de simplifier l’imagerie des modèles 3D.
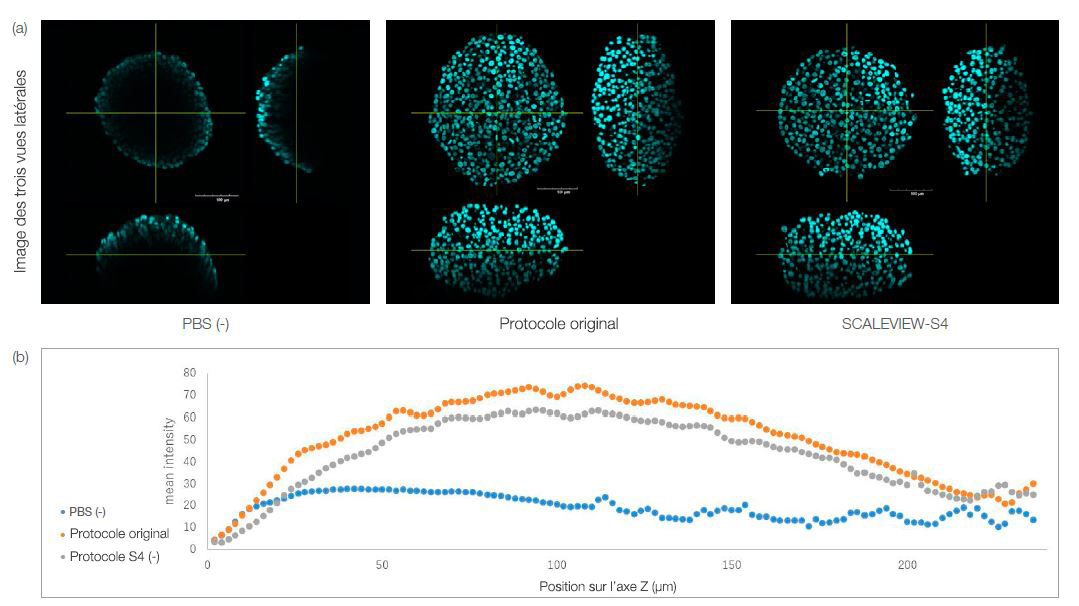
Fig. 1. Sphéroïdes de cellules HT-29 clarifiés à l’aide des protocoles SCALEVIEW-S et SCALEVIEW-S4. Les deux protocoles permettent de clarifier les sphéroïdes.
Importance de la concordance des IR des objectifs et des échantillons 3D
Pour obtenir des images précises des échantillons 3D clarifiés par microscopie multiphotonique ou confocale, vous devez faire en sorte que les IR des objectifs et des échantillons 3D soient identiques. Si les IR diffèrent, la qualité des images de l’échantillon 3D acquises en profondeur s’en trouvera affectée. En effet, une grande différence entre les IR des objectifs et des échantillons 3D entraîne la distorsion de l’objet sur l’axe Z à cause de l’aberration.
La figure 2 ci-dessous illustre une comparaison des résolutions des images de sphéroïdes de cellules HT-29 clarifiés avec le réactif S4 (IR : 1,47) prises avec les trois objectifs suivants : objectif à sec (IR : 1,00, UCPLFLN20X), objectif à immersion dans l’eau (IR : 1,33, UAPON20XW340) et objectif à immersion dans l’huile de silicone (IR : 1,40, UPLSAPO30XSIR)
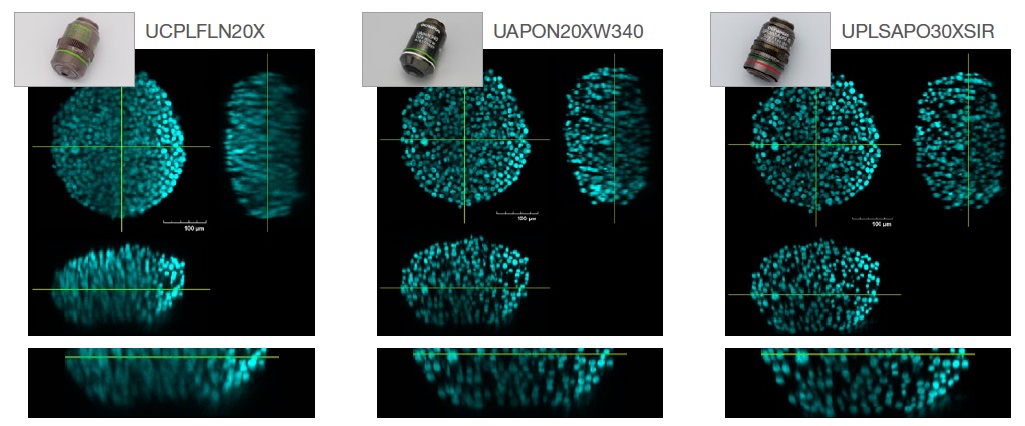
Fig. 2. Conséquences du choix de l’objectif sur la résolution des images. Gauche : sec (IR : 1,00, UCPLFLN20X). Milieu : eau (IR : 1,33, UAPON20XW340).
Droite : silicone (IR : 1,40, UPLSAPO30XSIR).
Comme illustré dans la figure 2, le choix d’un objectif avec un IR proche de celui de l’échantillon nous aide à acquérir des images plus nettes nous permettant de mieux comprendre la morphologie des échantillons 3D.
Conséquences de la clarification de sphéroïdes pour l’analyse 3D quantitative
Nous pouvons analyser de manière quantitative des échantillons 3D en les clarifiant et en prenant des images plusieurs plans Z avec un objectif adapté. Nous avons utilisé le logiciel d’analyse cellulaire 3D NoviSight™ pour réaliser une numération cellulaire 3D des sphéroïdes de cellules HT-29 marqués au DAPI avec ou sans clarification. Nous avons également comparé la précision de la numération cellulaire à partir des images 3D acquises avec des objectifs à immersion différents (fig. 2). Nous avons vérifié le nombre de cellules des sphéroïdes en les dissociant à la trypsine et en comptant manuellement les cellules.
L’analyse du nombre de cellules du logiciel NoviSight a détecté moins de 20 % du total des cellules (par rapport aux sphéroïdes dissociés à la trypsine) dans les sphéroïdes non clarifiés. À titre de comparaison, le logiciel a détecté plus de 90 % des cellules contenues dans les sphéroïdes clarifiés (fig. 3).
L’image prise avec un objectif à sec présentait probablement un nombre inférieur de cellules à celui des sphéroïdes dissociés à la trypsine du fait de la mauvaise identification des noyaux due à un faible rapport signal sur bruit (voir le rectangle rouge dans la figure 3). Bien que le logiciel ait identifié la quasi-totalité des noyaux sur l’image prise avec l’objectif à immersion dans l’eau, il n’a pas réussi à identifier les noyaux situés au plus profond du sphéroïde (rectangle jaune dans la figure 3).
Le logiciel a en revanche identifié la totalité des noyaux sur l’image prise avec l’objectif à immersion dans l’huile de silicone (rectangle vert dans la figure 3).
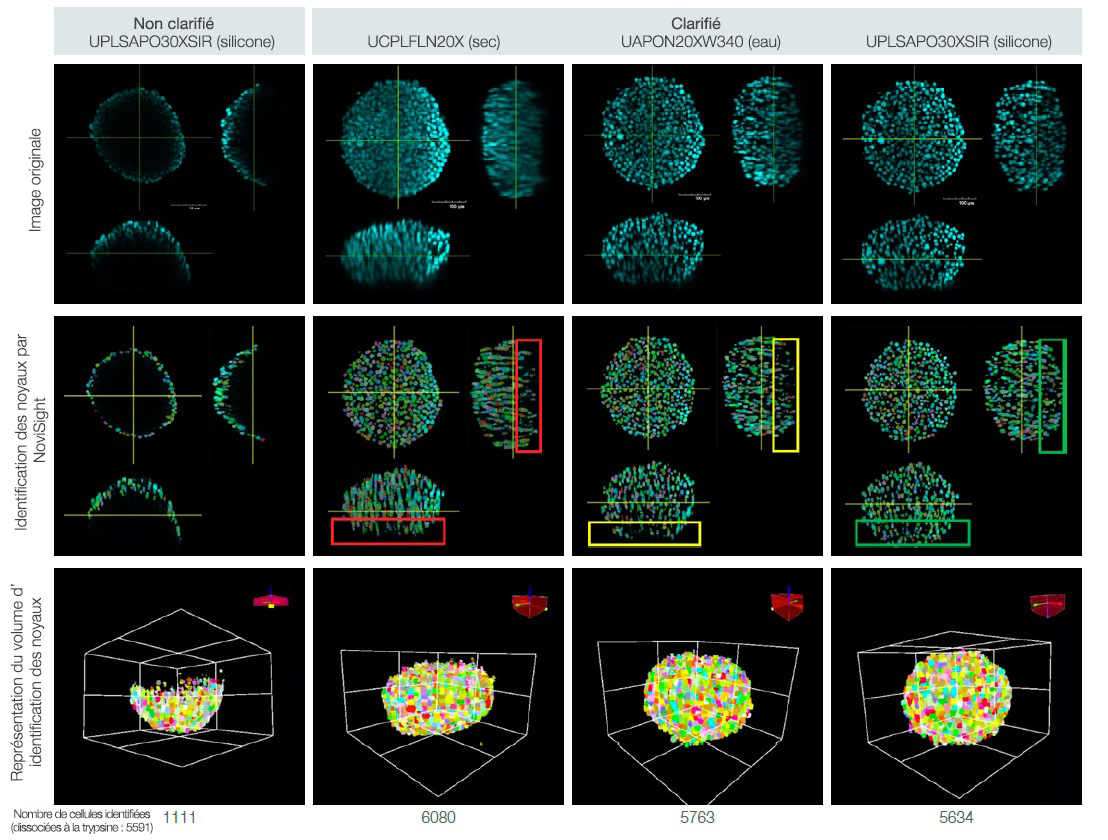
Fig. 3. Conséquences de la clarification des sphéroïdes et du choix de l’objectif sur la numération cellulaire 3D.
Conclusion
Les méthodes de clarification que nous avons testées nous ont permis de compter les cellules situées au plus profond des échantillons de sorte à pouvoir réaliser une analyse quantitative 3D.
Références
- Peng Wan et al., Evaluation of seven optical clearing methods in mouse brain, Neurophotonics (2018)
- Douglas S. Richardson et al., Clarifying Tissue Clearing, Cell (2015)
- Hama et al., ScaleS: an optical clearing palette for biological imaging, Nat Neurosci. (2015)
Auteur
Mayu Ogawa (Olympus)
Produits utilisés pour cette application
a bien été ajouté à vos favoris
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.