Die Bedeutung der Gewebeklärung und der Objektivauswahl bei der 3D-Analyse von Sphäroiden
Zusammenfassung
Dreidimensionale (3D) Modelle wie Sphäroide oder Organoide sind dick und infolge der Lichtstreuung opak. Dies macht es schwierig, Bilder tief aus ihrem Inneren zu erfassen und dabei ihre Morphologie intakt zu halten. Techniken zur Gewebeklärung machen jedoch durch Kontrolle der unterschiedlichen Brechungsindizes von Zellkompartimenten die Bildaufnahme im Inneren solcher Strukturen möglich.
In diesem Anwendungsbeispiel stellen wir ein Ein-Schritt-Protokoll zur Klärung von Sphäroiden mit dem Gewebeklärungsreagenz SCALEVIEW-S4 vor und erläutern die Bedeutung übereinstimmender Brechungsindizes zwischen den geklärten Sphäroiden und dem Objektiv.
Einleitung
3D-Modelle wie Sphäroide und Organoide werden häufig verwendet, da sie die In-vivo-Mikroumgebung genauer nachbilden als klassische 2D-Monolagenmodelle. Allerdings ist es schwierig, tiefe Bereiche dicker 3D-Modelle abzubilden, da zelluläre Bestandteile wie Lipide oder Pigmente Lichtstreuungen verursachen.
Inzwischen stehen jedoch eine Reihe von Techniken zur optischen Gewebeklärung zur Verfügung (1, 2), mit denen sich Sphäroide oder Organoide transparent machen lassen. Diese Klärungstechniken werden typischerweise in drei Arten unterteilt: lösungsmittelbasierte, wässrige und Hydrogel-Einbettungstechniken. SCALEVIEW-S, ein wässriges Klärungsreagenz, verursacht nur selten morphologische Veränderungen in den geklärten Proben (3).
In diesem Anwendungsbeispiel stellen wir die SCALEVIEW-S4 Sphäroid-Klärungsmethode vor. Da transparente 3D-Proben tendenziell einen hohen Brechungsindex haben, gehen wir außerdem auf den Effekt unterschiedlicher Brechungsindizes (RI) ein. Hierzu vergleichen wir Bilder, die mit einem Trockenobjektiv (RI: 1,0) oder mit einem Wasser- (RI: 1,33) oder Silikonöl-Immersionsobjektiv (RI: 1,4) aufgenommen wurden.
Materialien und Methoden
Probenvorbereitung
Humane kolorektale Adenokarzinomzellen (Linie HT-29) wurden in eine 384-Well-Mikroplatte mit Rundboden ausgesät und inkubiert, bis der Durchmesser der gebildeten Sphäroide etwa 300 μm betrug. Die Sphäroide wurden über Nacht bei 4 °C mit 4 % Paraformaldehydlösung (PFA) fixiert und mit DAPI-Lösung in PBS angefärbt.
Klärungsmethode
SCALEVIEW-S0, S1, S2, S3, S4 und die Entkalkungslösung wurden gekauft (FUJIFILM Wako Chemicals) oder hergestellt (3). Tabelle 1 zeigt das ursprüngliche Protokoll für die Verwendung dieser Reagenzien.
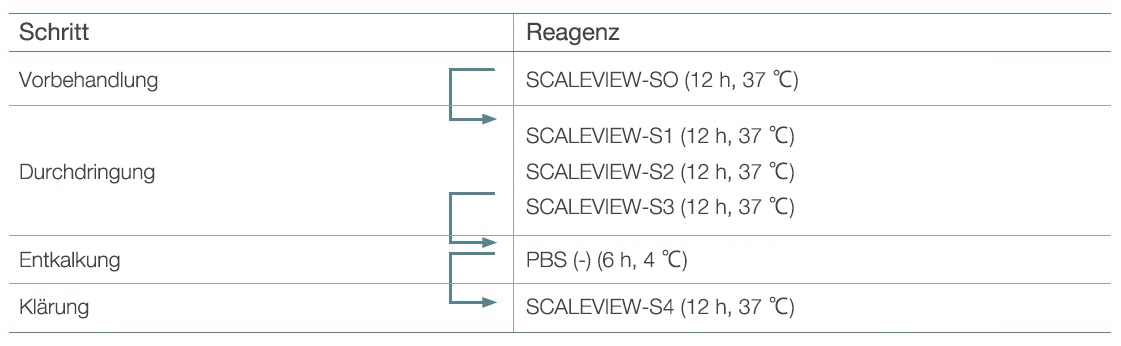
Tabelle 1: Ursprüngliches SCALEVIEW-S-Protokoll
Bildaufnahme
Die DAPI-gefärbten HT-29-Sphäroide wurden ohne Klärung mit dem konfokalen FLUOVIEW FV3000 Laser-Scanning-Mikroskop und den drei verschiedenen oben genannten Immersionsobjektiven aufgenommen.
Ergebnisse und Diskussion
Ein-Schritt-Klärung von Sphäroiden mit SCALEVIEW-S4
Das ursprüngliche SCALEVIEW-S-Protokoll erfordert den sequenziellen Austausch von sechs verschiedenen Reagenzien (S0 bis S4, Entkalkung). Während der Behandlung mit den Reagenzien S0 bis S3 und der Entkalkungslösung expandiert die Probe und kontrahiert wieder, sodass S4 das Gewebe klären und ihr Volumen auf fast 100 % der ursprünglichen Größe zurückbringen kann.
Das ursprüngliche Protokoll ist für die Klärung ganzer Mausgehirne optimiert, sodass jedes Reagenz etwa 12 Stunden einwirken muss, bis die Probe geklärt ist. Da die etwa 200–300 μm dicken Sphäroide oder Organoide viel kleiner sind als ein Mausgehirn, können sie nach Fixierung und Färbung durch eine etwa einstündige Inkubation in Reagenz S4 unter leichter Bewegung geklärt werden.
Sowohl bei dem nur mit S4 geklärten als auch bei dem entsprechend dem ursprünglichen Protokoll behandelten Sphäroid blieb die Morphologie erhalten, wie in Abb. 1a dargestellt. Die Fluoreszenzintensität in den geklärten Sphäroiden für die einzelnen Z-Positionen ist in Abb. 1b dargestellt. Die quantitativen Ergebnisse zeigen, dass das Sphäroid durch Behandlung mit S4 allein geklärt werden kann. Dies bedeutet, dass kleine 3D-Modelle wie Sphäroide oder Organoide nach Fixierung und Färbung problemlos mit einen Ein-Schritt-Protokoll geklärt werden können, was das Imaging von 3D-Modellen vereinfacht.
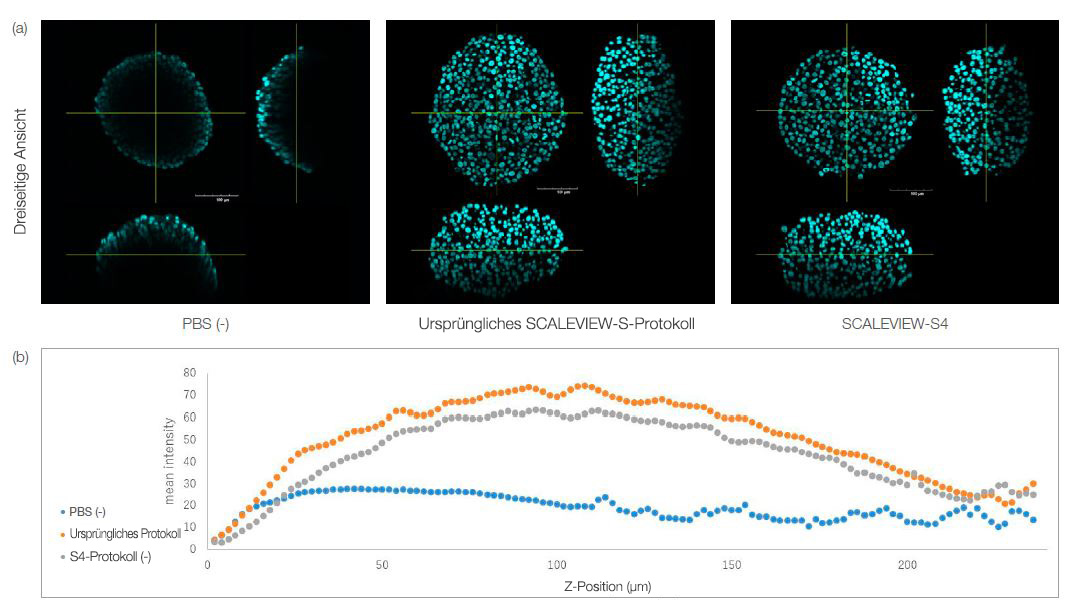
Abb. 1. HT-29-Sphäroide, geklärt mit dem SCALEVIEW-S- und dem SCALEVIEW-S4-Protokoll. Mit beiden Protokollen kann das Sphäroid geklärt werden.
Bedeutung übereinstimmender Brechungsindizes zwischen Objektiven und 3D-Proben
Um mit der konfokalen oder Multiphotonenmikroskopie präzise Bilder von geklärten 3D-Proben zu erhalten, muss bei Objektiven und 3D-Proben auf übereinstimmende Brechungsindizes (RI) geachtet werden. Andernfalls beeinflussen die voneinander abweichenden RI die Bildqualität in tiefen Bereichen der 3D-Proben. In diesem Fall führte ein größerer Unterschied zwischen dem RI des Objektivs und dem der 3D-Probe zu einer aberrationsbedingten Verzerrung des Objekts in Z-Richtung.
In der nachstehenden Abbildung 2 wird die Bildauflösung bei Aufnahmen der S4-geklärten HT-29-Sphäroide (RI: 1,47) verglichen, die mit drei verschiedenen Objektiven erhalten wurden: einem Trockenobjektiv (RI: 1,00, UCPLFLN20X), einem Wasserimmersionsobjektiv (RI: 1,33, UAPON20XW340) und einem Silikonöl-Immersionsobjektiv (RI:1,40, UPLSAPO30XSIR)
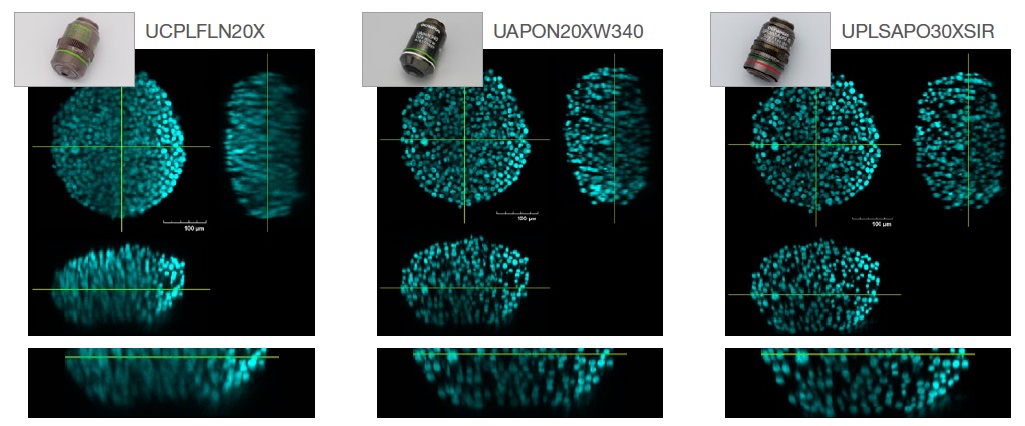
Abb. 2. Der Einfluss der Objektivauswahl auf die Bildauflösung. Links: Trockenobjektiv (RI: 1,00, UCPLFLN20X). Mitte: Wasserimmersionsobjektiv (RI: 1,33, UAPON20XW340).
Rechts: Silikonöl-Immersionsobjektiv (RI:1,40, UPLSAPO30XSIR).
Wie in Abb. 2 dargestellt, trägt die Auswahl des optimalen Objektivs im Hinblick auf übereinstimmende RI zur Aufnahme klarer Bilder bei, die einen genaueren Einblick in die Morphologie von 3D-Proben geben.
Auswirkungen der Klärung von Sphäroiden auf die quantitative 3D-Analyse
3D-Proben können quantitativ analysiert werden, indem nach ihrer Klärung mehrere Bilder in der Z-Ebene von ihnen aufgenommen werden – und zwar mit einem geeigneten Objektiv. Hier wurde die NoviSight Zellanalyse-Software eingesetzt, um an geklärten und nicht geklärten, DAPI-gefärbten HT-29-Sphäroiden eine 3D-Zellzählung vorzunehmen. Darüber hinaus wurde ein Vergleich der Genauigkeit der Zellzählung zwischen 3D-Bildern durchgeführt, die mit verschiedenen Immersionsobjektiven aufgenommen wurden (Abb. 2). Um die Zellzahl in Sphäroiden zu bestimmen, wurden diese trypsinisiert und die Zellen manuell gezählt.
Mit der Zellzählungsfunktion der NoviSight Software wurden in einem nicht geklärten Sphäroid (verglichen mit trypsinisierten Sphäroiden) weniger als 20 % der gesamten Zellen erkannt. Im Gegensatz dazu erkannte die Software in einem geklärten Sphäroid mehr als 90 % der gesamten Zellen (Abb. 3).
Das mit dem Trockenobjektiv aufgenommene Bild ergab möglicherweise eine kleinere Zellzahl als die trypsinisierten Sphäroide, weil die Zellerkennung durch ein schlechtes Signal-Rausch-Verhältnis beeinträchtigt war (siehe das rote Rechteck in Abb. 3). Und während die Software auf dem mit dem Wasserimmersionsobjektiv aufgenommenen Bild in nahezu allen Fällen den Zellkern erkannte, wurde der Zellkern tief im Innern des Sphäroids übersehen (gelbes Rechteck in
Abb. 3).
Die Software erkannte jedoch alle Zellkerne auf dem mit dem Silikonöl-Immersionsobjektiv aufgenommenen Bild (grünes Rechteck in Abb. 3).
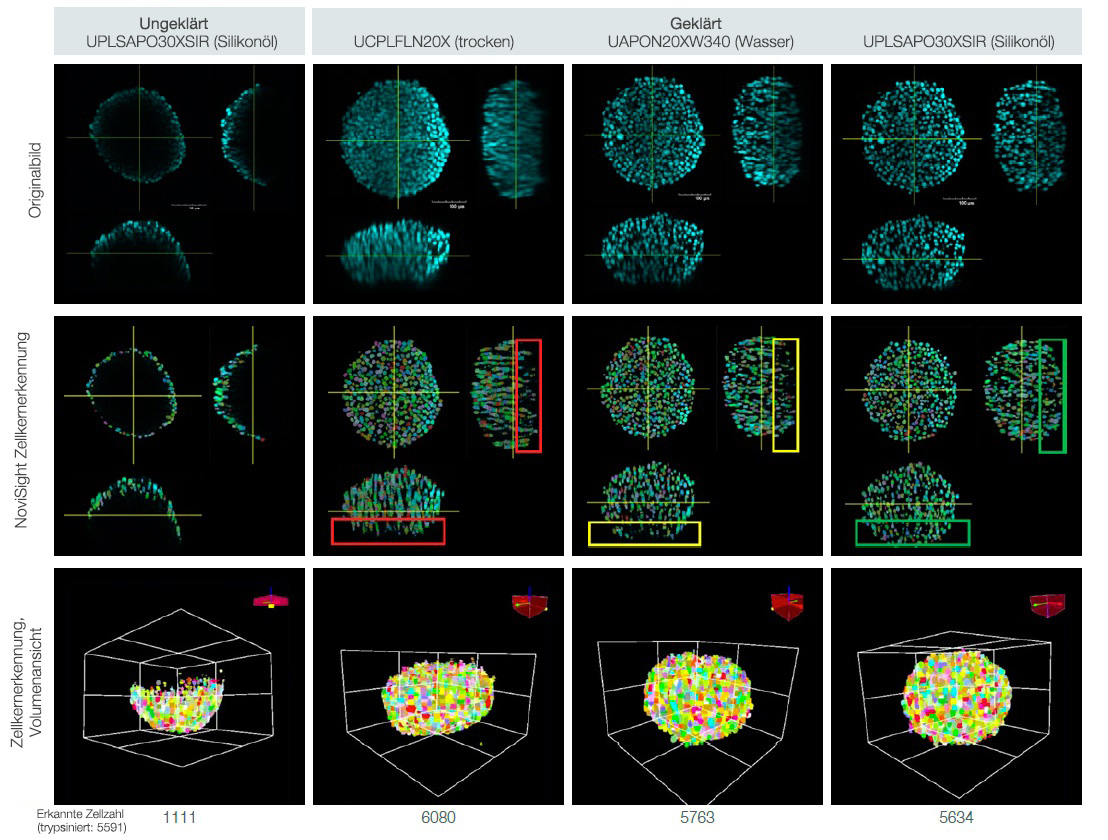
Abb. 3. Auswirkungen der Sphäroid-Klärung und der Objektivauswahl auf die 3D-Zellzählung.
Schlussfolgerung
Klärungstechniken ermöglichten die Zählung von Zellen tief im Inneren der Probe, sodass eine quantitative 3D-Analyse durchführbar war.
Literaturnachweis
- Peng Wan et al., Evaluation of seven optical clearing methods in mouse brain, Neurophotonics (2018)
- Douglas S. Richardson et a., Clarifying Tissue Clearing, Cell (2015)
- Hama et al., ScaleS: an optical clearing palette for biological imaging, Nat Neurosci. (2015)
Autor
Mayu Ogawa (Olympus)
Verwendete Produkte
wurde erfolgreich zu Ihren Lesezeichen hinzugefügt
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.