스페로이드의 3D 분석에서 조직 세정 및 대물렌즈 선택의 중요성
요약
스페로이드 또는 오르가노이드 같은 3차원(3D) 모델은 광산란으로 인해 두껍고 불투명하므로 전체 형태를 유지하면서 이들 모델 내부에 깊이 있는 이미지를 획득하기가 어렵습니다. 하지만 조직 세정 기법을 이용하면 세포 격실 간 각기 다른 굴절률(RI)을 제어하여 이들 샘플 내부에 깊이 있는 이미지를 획득할 수 있습니다.
이 애플리케이션 노트에서는 투명화된 스페로이드와 대물렌즈 간 RI 일치의 중요성을 설명할 뿐 아니라 SCALEVIEW-S4 조직 투명화 시약을 사용한 원스텝 스페로이드 투명화 프로토콜을 소개합니다.
서론
스페로이드와 오르가노이드 같은 3D 모델은 전형적인 2D보다 더 정밀하게 체내 미세환경과 흡사하기 때문에 인기가 있습니다. 하지만 지질 또는 색소 침착 같은 세포 격실에 의해 야기된 광산란으로 인해 두꺼운 3D 모델의 심도 있는 부분의 이미지 획득이 어렵습니다.
현재는 많은 광학 조직 투명화 기법(1, 2)을 통해 스페로이드 또는 오르가노이드를 투명하게 할 수 있습니다. 이러한 투명화 기법은 일반적으로 용제 기반, 수성 기반 및 히드로겔 삽입 기법 등 세 가지 유형으로 나뉩니다. 수성 투명화 시약인 SCALEVIEW-S는 투명화된 샘플(3)의 형태적 변화를 거의 야기하지 않습니다.
이 애플리케이션 노트에서는 SCALEVIEW-S4 스페로이드 투명화 방법을 따릅니다. 투명한 3D 샘플은 굴절률이 높은 경향이 있기 때문에 건식(RI: 1.0), 습식(RI: 1.33) 및 실리콘(RI: 1.4) 대물렌즈를 사용하여 획득된 이미지들을 비교하여 RI 불일치의 영향도 설명합니다.
재료 및 방법
샘플 준비
인간 직장 결장 선암종 세포(라인 HT-29)가 384웰 U자형 바닥 마이크로플레이트에 파종되어 스페로이드 직경이 약 300μm이 될 때까지 배양되었습니다. 스페로이드는 4°C(39.2°F)로 하룻밤 동안 4% 파라포름알데히드(PFA) 용액으로 고정되고 PBS(-)에서 DAPI 용액으로 착색되었습니다.
투명화 방법
SCALEVIEW-S0, S1, S2, S3, S4 및 디스케일링 용액을 구매하거나(FUJIFILM Wako Chemicals) 제조하였습니다(3). 표 1은 이러한 시약을 사용한 오리지널 프로토콜을 보여줍니다.
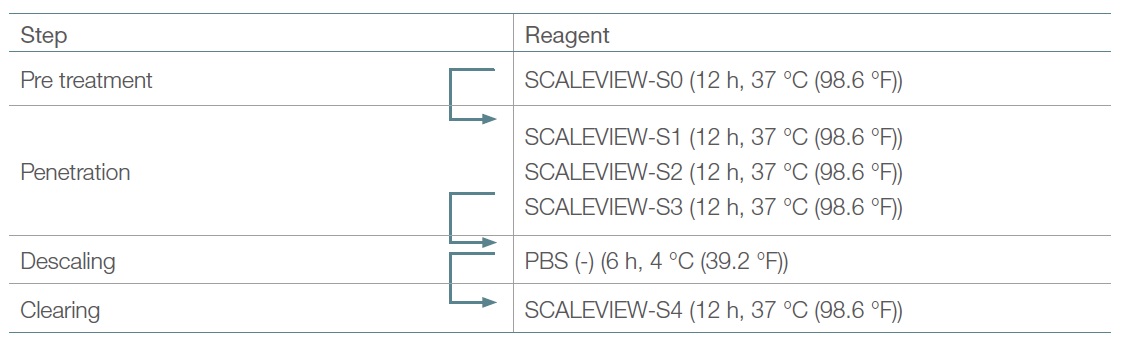
표 1. 오리지널 SCALEVIEW-S 프로토콜
이미징 방법
FLUOVIEW FV3000 컨포칼 레이저 스캐닝 현미경과 위에 설명된 세 가지 이멀젼 대물렌즈를 사용하여 투명화 적용 및 미적용 DAPI 착색 HT-29 스페로이드의 이미지를 획득하였습니다.
결과 및 논의
SCALEVIEW-S4를 사용한 원스텝 스페로이드 투명화
오리지널 SCALEVIEW-S 프로토콜에는 여섯 가지 시약(S0–S4, 디스케일링)의 순차적 액체 교환이 수반됩니다. 샘플은 시약 S0–S3 및 디스케일링 용액으로 처리 중 확대되고 수축되며 이를 통해 S4가 조직을 세정하고 부피를 원래 크기의 거의 100%로 복구합니다.
오리지널 프로토콜은 쥐의 전체 뇌를 투명화하는 데 최적화되어 있으므로 각 시약이 샘플을 투명화하는 데 약 12시간 소요됩니다. 대략 200–300μm 두께의 스페로이드 또는 오르가노이드는 쥐의 뇌보다 훨씬 더 작기 때문에 고정되고 착색된 후 약 1시간 동안 부드럽게 회전시켜 시약 S4의 배양으로 투명화될 수 있습니다.
S4로 세정된 스페로이드와 오리지널 프로토콜로 투명화된 스페로이드 모두 아래 그림 1a에 표시된 대로 그 형태를 유지하였습니다. 그림 1b에서 각 Z 위치에 대해 각기 투명화된 스페로이드의 형광 강도를 확인할 수 있습니다. 결과는 스페로이드가 S4의 단일 시약 처리를 사용하여 투명화될 수 있음을 정량적으로 보여줍니다. 즉 스페로이드 또는 오르가노이드 같이 작은 3D 모델은 고정되고 착색된 후 S4를 사용하여 원스텝 프로토콜로 쉽게 투명화될 수 있으며 이를 통해 3D 모델 이미징이 간소화됩니다.
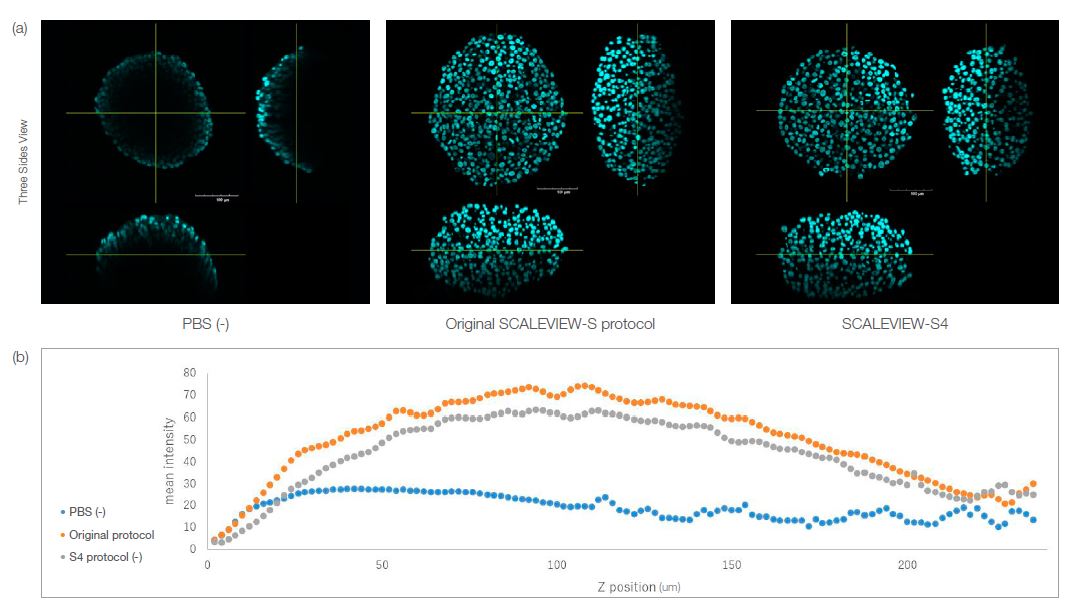
그림 1. SCALEVIEW-S 및 SCALEVIEW-S4 프로토콜을 사용하여 세정된 HT-29 스페로이드. 두 프로토콜 모두 스페로이드를 세정할 수 있습니다.
대물렌즈와 3D 샘플 간 RI 일치의 중요성
컨포칼 또는 다광자 현미경을 사용하여 투명화된 3D 샘플의 정확한 이미지를 획득하려면 대물렌즈와 3D 샘플 간 RI 일치를 고려해야 합니다. 그렇지 않으면 RI 불일치가 3D 샘플 심도의 품질에 영향을 미칩니다. 이 경우에 대물렌즈와 3D 샘플 간 RI의 차이가 크기 때문에 수차로 인해 Z 방향으로 객체 왜곡이 야기되었습니다
아래 그림 2는 건식(RI: 1.00, UCPLFLN20X), 습식(RI: 1.33, UAPON20XW340) 및 실리콘(RI:1.40, UPLSAPO30XSIR) 이멀젼 등 세 가지 대물렌즈로 캡처되고 S4로 투명화된 HT-29 회전 타원체(RI: 1.47)의 이미지 해상도를 비교합니다.
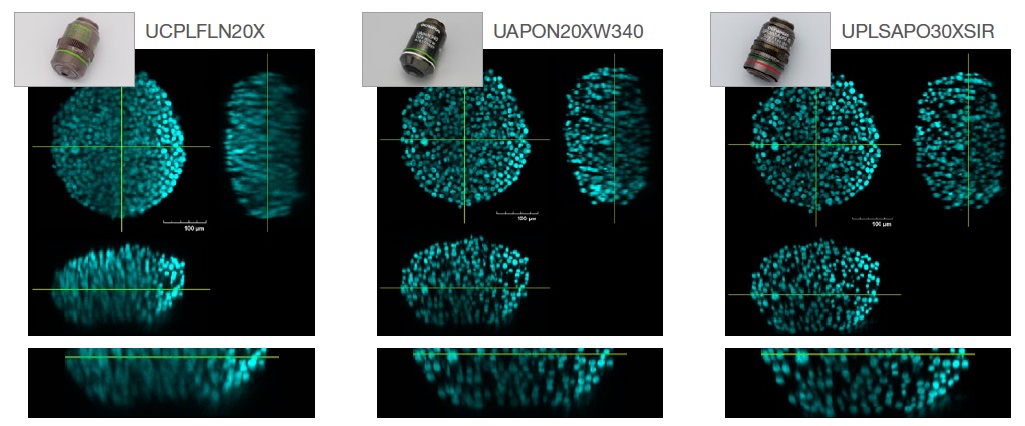
그림 2. 대물렌즈 선택이 이미지 해상도에 미치는 영향. 좌측: 건식(RI: 1.00, UCPLFLN20X). 중앙: 습식(RI: 1.33, UAPON20XW340).
우측: 실리콘(RI: 1.40, UPLSAPO30XSIR) 이멀젼).
그림 2에 표시된 바와 같이 RI 일치의 최적 대물렌즈 선택은 3D 샘플의 형태를 더 정확히 이해하기 위해 명료한 이미지를 획득하는 데 도움이 됩니다.
3D 정량 분석을 위한 스페로이드 투명화의 효과
3D 샘플을 투명화하고 적절한 대물렌즈로 여러 Z 평면 이미지를 획득하여 3D 샘플을 정량적으로 분석할 수 있습니다. NoviSight™ 3D 세포 분석 소프트웨어를 사용하여 투명화 적용 및 미적용 DAPI 착색 HT-29 스페로이드에 3D 세포 계수를 수행하였습니다. 각기 다른 이멀젼 대물렌즈를 사용하여 획득된 3D 이미지 간에 세포 계수 정확도도 비교하였습니다(그림 2). 스페로이드를 트립신처리하고 세포 수를 수동으로 계산하여 스페로이드 세포 수를 확인하였습니다.
NoviSight 소프트웨어의 세포 계수 분석을 통해 비세정 스페로이드에서 (트립신처리된 스페로이드 대) 총 세포의 20% 미만을 검출하였습니다. 이와 대조적으로 소프트웨어는 투명화된 스페로이드에서 총 세포의 90% 이상을 검출하였습니다(그림 3).
열악한 신호 대 잡음비의 오인식으로 인해 건식 대물렌즈 이미지의 세포 수는 트립신처리된 스페로이드보다 더 적을 것을 예상되었습니다(그림 3의
빨간색 직사각형 참조). 소프트웨어는 습식 대물렌즈 이미지의 핵들을 거의 완전히 검출한 반면에 스페로이드 내부에 깊이 있는 핵을
상실하였습니다(그림 3의 노란색 직사각형).
하지만 소프트웨어는 실리콘 대물렌즈 이미지의 핵들을 완전히 인식하였습니다(그림 3의 녹색 직사각형).
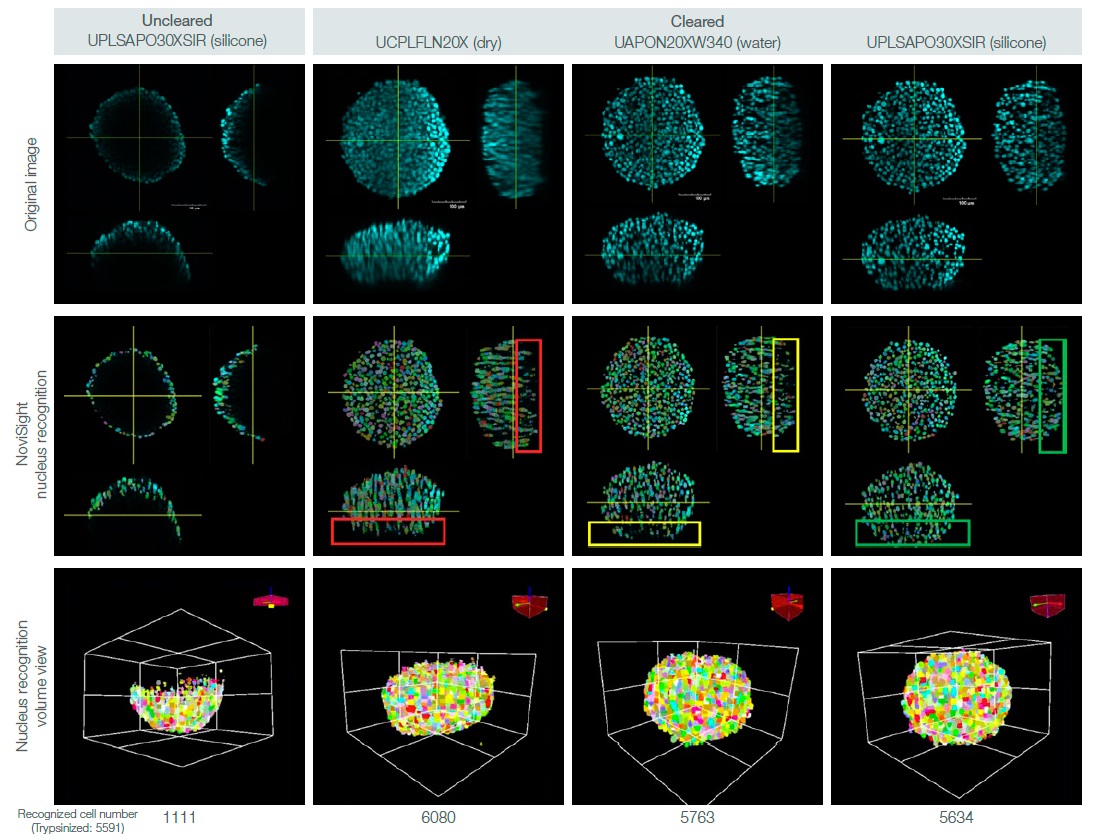
그림 3. 스페로이드 세정 및 대물렌즈 선택이 3D 세포 계수에 미치는 영향.
결론
투명화 기법을 통행 샘플 내부에 깊이 있는 세포를 계산할 수 있으므로 3D 정량 분석을 달성할 수 있었습니다.
참고문헌
- Peng Wan et al., Evaluation of seven optical clearing methods in mouse brain, Neurophotonics (2018)
- Douglas S. Richardson et a., Clarifying Tissue Clearing, Cell (2015)
- Hama et al., ScaleS: an optical clearing palette for biological imaging, Nat Neurosci. (2015)
저자
Mayu Ogawa(Olympus)
이 애플리케이션에 사용되는 제품
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
Not Available in Your Country
Sorry, this page is not
available in your country.