微球3D分析中组织透明化和目标选择的重要性
总结
由于光的散射所致,诸如微球或类器官的三维(3D)模型既厚又不透明,因此在保持整体形态的同时很难对其进行深层成像。但是,组织透明化技术可以通过控制细胞隔室之间的不同折射率(RI)对这些样品的内部进行成像。
在本应用指南中,我们介绍一种使用SCALEVIEW-S4组织透明化试剂的一步法微球透明化方案,并说明透明化微球与物镜之间折射率匹配的重要性。
引言
3D模型(如微球和类器官)之所以受欢迎,是因为其比经典2D单层模型更为精确地模拟体内微环境。但由于脂质或色素沉着等细胞内容物引起的光散射,较厚3D模型很难进行深层成像 。
如今,很多光学组织透明化技术(1、2)均可实现微球或类器官的透明化。这些透明化技术通常分为三种类型:基于溶剂,基于水和水凝胶包埋技术。SCALEVIEW-S是一种几乎不会引起透明化样品形态变化的水性透明化试剂(3)。
在本应用指南中,我们采用的是SCALEVIEW-S4微球透明化方法。由于透明3D样品往往具有较高的折射率,因此我们还通过比较使用干式(RI:1.0)、水浸(RI:1.33)和硅油浸(RI:1.4) 物镜介绍了折射率匹配不佳的影响。
材料和方法样品的制备
将人结肠直肠腺癌细胞(HT-29株)种入384孔U型底微孔板中,并将微球培养至直径约300μm。将微球在4°C(39.2°F)下使用4%多聚甲醛(PFA)溶液过夜固定,并用PBS(-)中的DAPI溶液染色。
透明化方法
可购买(FUJIFILM Wako Chemicals)或制造SCALEVIEW-S0、S1、S2、S3、S4和除垢溶液(3)。表1介绍了使用这些试剂的原始方法。
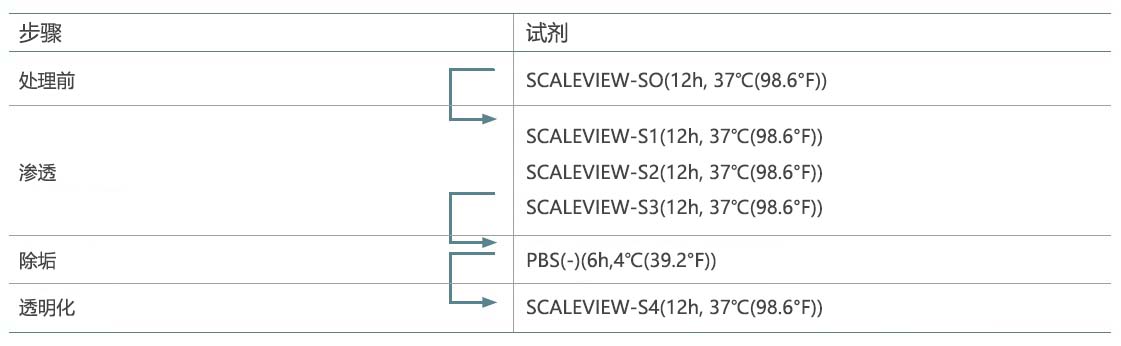
表1.原始SCALEVIEW-S方案
成像方法
我们使用FLUOVIEW FV3000激光扫描共聚焦显微镜和上述三个不同类型的浸没物镜对经过透明化处理和未经透明化处理的DAPI染色HT-29微球进行了成像。
结果与讨论
使用SCALEVIEW-S4进行单步微球透明化
原始SCALEVIEW-S方案涉及六种不同试剂的顺序液体交换(S0-S4,除垢)。在使用试剂S0-S3和除垢溶液处理期间,样品会膨胀和收缩,从而让S4能够将组织透明化并将体积几乎恢复到其原始大小的100%。
原始方案经过优化,可以透明化整个小鼠的大脑,因此每种试剂透明化样品大约需要12个小时。由于厚度大约200-300μm的微球或类器官比老鼠的大脑小得多,因此在固定并染色后,在试剂S4中孵育约一小时,然后轻轻旋转即可将其透明化。
经过S4透明化的微球和使用原始方案透明化的微球均保持形态,如下图1a所示。您可以在图1b中看到每个Z位置每个透明化微球的荧光强度。结果以定量方式表明,使用S4的单试剂处理可以将微球透明化。这意味着在固定并染色后,可以使用S4通过一步操作轻松透明化像微球或类器官之类的小型3D模型,从而让3D模型成像得到简化。
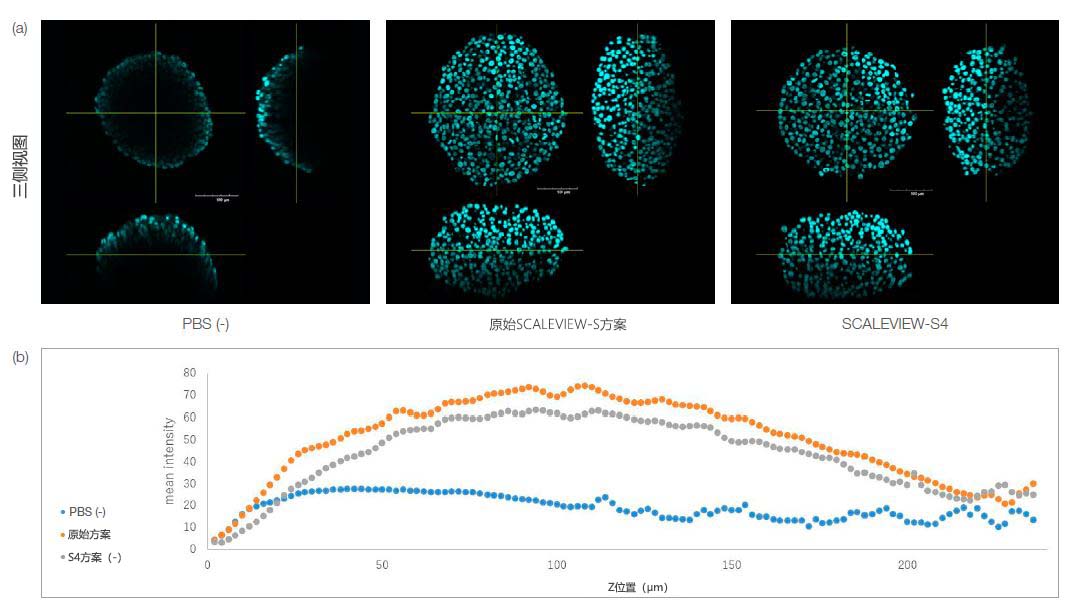
图1.使用SCALEVIEW-S和SCALEVIEW-S4方案透明化的HT-29微球。两种方案均可透明化微球。
物镜和3D样品之间折射率匹配的重要性
若要使用共聚焦或多光子显微镜获得透明化3D样品的精确图像,必须留意物镜和3D样品之间的折射率匹配。否则,折射率不匹配将会影响3D样品深层的图像质量。在这种情况下,物镜和3D样品之间的较大的折射率差异会造成因像差导致物体在Z方向上变形。
下面的图2比较了采用以下三种物镜捕捉S4透明化HT-29微球图像的分辨率(RI:1.47):干式(RI:1.00,UCPLFLN20X),水浸(RI:1.33,UAPON20XW340)和硅油浸(RI:1.40,UPLSAPO30XSIR)
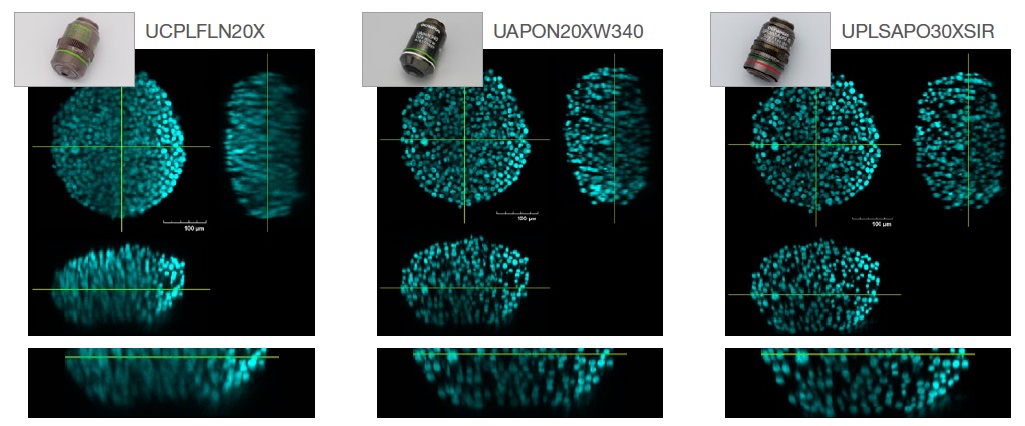
图2.物镜选择对图像分辨率的影响。左:干式(RI:1.00, UCPLFLN20X)。中:水浸(RI:1.33, UAPON20XW340)。
右:硅油浸(RI:1.40, UPLSAPO30XSIR) )。
如图2所示,选择匹配折射率的最佳物镜可以帮助我们获取清晰图像,从而更准确理解3D样品的形态。
微球透明化对3D定量分析的影响
我们可以通过将3D样品透明化并使用适当物镜获取多个Z平面图像对3D样品进行定量分析。我们使用NoviSight™3D细胞分析软件对经过或未经过透明化处理的DAPI染色HT-29椭微球进行3D细胞计数。我们还比较了使用不同浸没物镜所捕捉3D图像之间细胞计数的准确性(图2)。我们通过胰蛋白酶处理微球细胞数并手动计数细胞数对其进行检查。
NoviSight软件的细胞计数分析检测到未经透明化的微球中不到20%的总细胞数(相对于经过胰蛋白酶处理的微球)。相反,该软件在透明化微球中检测到90%的总细胞数(图3)。
干式物镜图像可能比经胰蛋白酶处理的微球细胞数更少少,这是由于不良信噪比导致的误识别所致(参见图3中的红色矩形)。尽管该软件几乎完全检测到水浸物镜图像中的细胞核,但其却无法检测到微球内部的细胞核(图3中的黄色矩形)。
但是,该软件可以完全识别硅油浸没物镜图像中的细胞核(图3中的绿色矩形)。
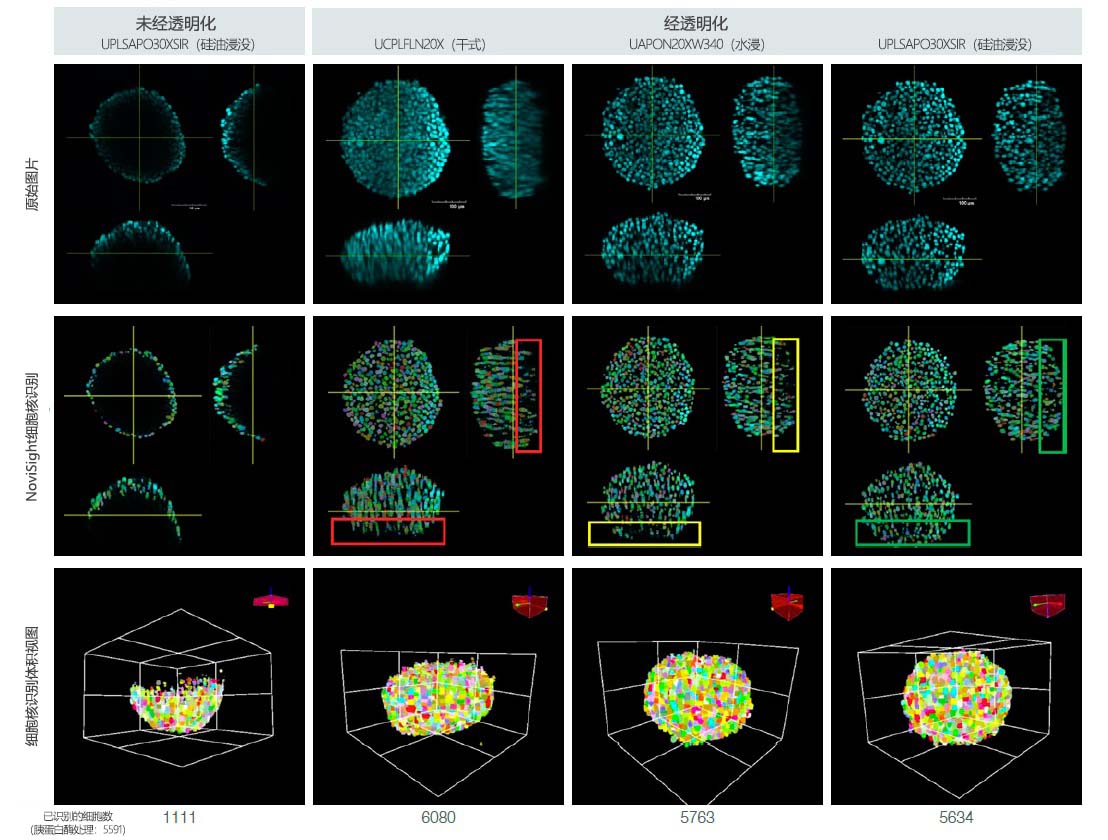
图3.微球透明化和物镜选择对3D细胞计数的影响。
结论
透明化技术让我们能够对样品内部的细胞进行计数,从而实现3D定量分析。
参考文献
- Peng Wan等人,小鼠大脑七种光学透明化方法评估,Neurophotonics(2018)
- Douglas S.Richardson等人,澄清组织透明化,Cell (2015)
- Hama等人,ScaleS:用于生物成像的光学透明化调色板,Nat Neurosci。(2015)
作者
Mayu Ogawa(奥林巴斯)
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。