スフェロイドの三次元解析における組織透明化と対物レンズ選択の重要性
要約
スフェロイドやオルガノイドのような3次元(3D)モデルは厚みがあり、光の散乱のせいで不透明です。そのため、全体の形態を維持しながらモデルの深部でイメージングを行うことは困難です。しかし、組織透明化技術は、細胞間で異なる屈折率(RI)を均一にすることによって、これらのサンプルの深部のイメージングを可能にします。
このアプリケーションノートでは、SCALEVIEW-S4組織透明化試薬を用いたワンステップのスフェロイド透明化プロトコルを紹介すると共に、透明化されたスフェロイドと対物レンズのRIを一致させることの重要性についてご説明します。
序論
スフェロイドやオルガノイドのような3次元モデルは、従来の2次元単層モデルよりも正確に生体内微小環境を再現できるため、よく使われています。しかし、脂質や色素沈着など、細胞の区画によって生じる光の散乱のために、厚みのある3次元モデルの深部でイメージングを行うことは困難です。
現在、多くの光学的組織透明化技術(1、2)によってスフェロイドやオルガノイドを透明にすることができます。これらの透明化技術は一般に3種類に分類されます。つまり、溶剤ベースの技術、水溶液ベースの技術、およびハイドロゲル埋め込み技術です。水溶性の透明化試薬であるSCALEVIEW-Sは、透明化したサンプルの形態を変化させることはめったにありません(3)。
このアプリケーションノートでは、SCALEVIEW-S4スフェロイド透明化法を使用しています。透明な3次元サンプルは屈折率が高い傾向があるため、ドライ系対物レンズ(RI:1.0)、水浸対物レンズ(RI:1.33)、シリコーンオイル浸対物レンズ(RI:1.4)を使用して取得した画像を比較することによって、RIの不一致の影響についてもご説明します。
材料と方法
サンプルの作製
ヒト結腸直腸腺がん細胞(HT-29株)を384ウェルU底マイクロプレートに播種し、スフェロイドの直径が約300 μmになるまで培養しました。4%パラホルムアルデヒド(PFA)溶液でスフェロイドを4°C(39.2°F)で一晩固定して、PBS(-)で希釈したDAPI溶液で染色しました。
透明化の方法
SCALEVIEW-S0、S1、S2、S3、S4およびdeScale Solutionを購入(富士フイルム和光純薬)または作製しました(3)。表1にこれらの試薬を用いた本来のプロトコルを示しました。
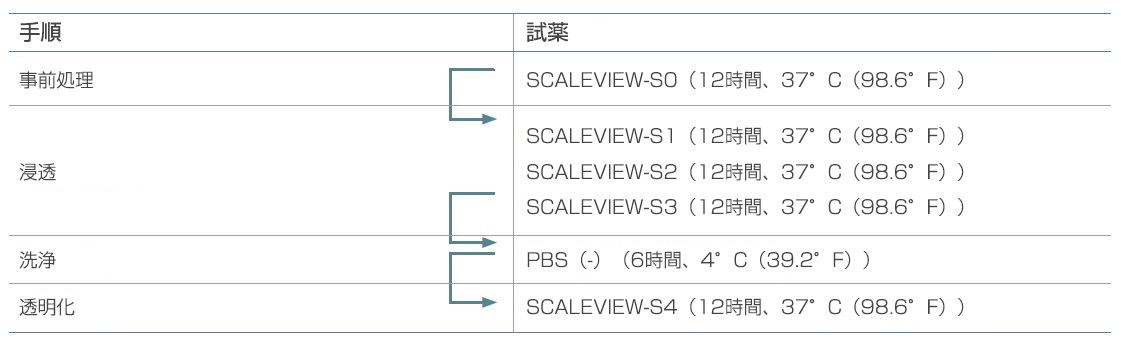
表1. 本来のSCALEVIEW-Sプロトコル
イメージングの方法
DAPIで染色したHT-29スフェロイドの透明化したものと透明化していないものについて、FLUOVIEW共焦点走査型レーザー顕微鏡FV3000と上記の浸液の点で異なる3種類の対物レンズを使用して、イメージングを行いました。
結果と考察
SCALEVIEW-S4を用いたワンステップのスフェロイド透明化
本来のSCALEVIEW-Sプロトコルでは、6種類の試薬(S0~S4、deScale Solution)の連続的な液交換が必要です。試薬S0~S3およびdeScale Solutionで処理している間に、サンプルが膨張・収縮します。そこで、S4を用いれば組織を透明化した上で、体積を元の大きさのほぼ100%まで戻すことができます。
本来のプロトコルは、マウス脳全体を透明化するために最適化されているため、それぞれの試薬がサンプルを透明化するのに約12時間かかります。厚さが約200~300 μmのスフェロイドやオルガノイドはマウス脳よりもかなり小さいため、試薬S4中で約1時間培養し、固定と染色の後で弱く回転させることによって透明化することができます。
以下の図1aに示すように、S4のみで透明化したスフェロイドと本来のプロトコルを使用して透明化したスフェロイドは、どちらも形態を維持していました。透明化した個々のスフェロイドのZ位置ごとの蛍光強度については、図1bをご覧ください。これらの結果は、試薬S4だけによる処理でスフェロイドを透明化できることを定量的に示しています。つまり、スフェロイドやオルガノイドのような小型の3次元モデルは、固定・染色した後にS4を用いたワンステッププロトコルを行うことによって、簡単に透明化できるということであり、これは3次元モデルのイメージングを簡単にするのに役立ちます。
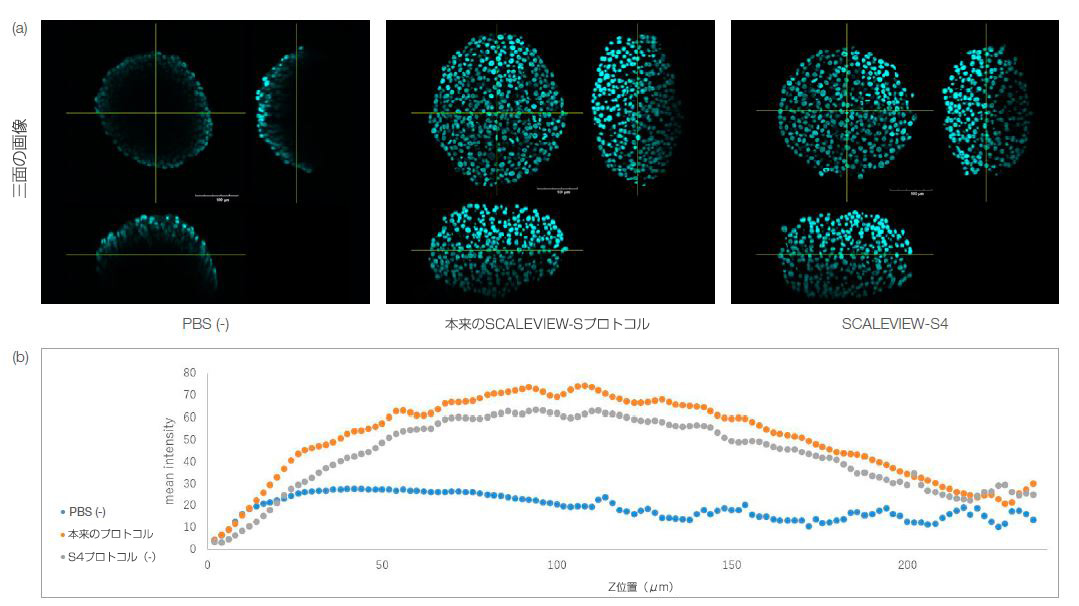
図1.
SCALEVIEW-SプロトコルとSCALEVIEW-S4プロトコルを使用して透明化したHT-29スフェロイド。どちらのプロトコルでもスフェロイドを透明化することができます。
対物レンズと3次元サンプルのRIを一致させることの重要性
共焦点顕微鏡や多光子顕微鏡を使用して、透明化された3次元サンプルの精密な画像を取得するためには、対物レンズと3次元サンプルのRIを一致させることを考慮しなければなりません。そうしないと、RIの不一致が3次元サンプルの深部の画質に影響を及ぼします。この場合、対物レンズと3次元サンプルのRIが大きく異なっていたため、収差により対象物がZ方向に変形しました。
以下の図2では、S4で透明化したHT-29スフェロイド(RI:1.47)について、ドライ系(RI:1.00、UCPLFLN20X)、水浸(RI:1.33、UAPON20XW340)、シリコーンオイル浸(RI:1.40、UPLSAPO30XSIR)という3種類の対物レンズを使用して取得した画像の解像度を比較しています。
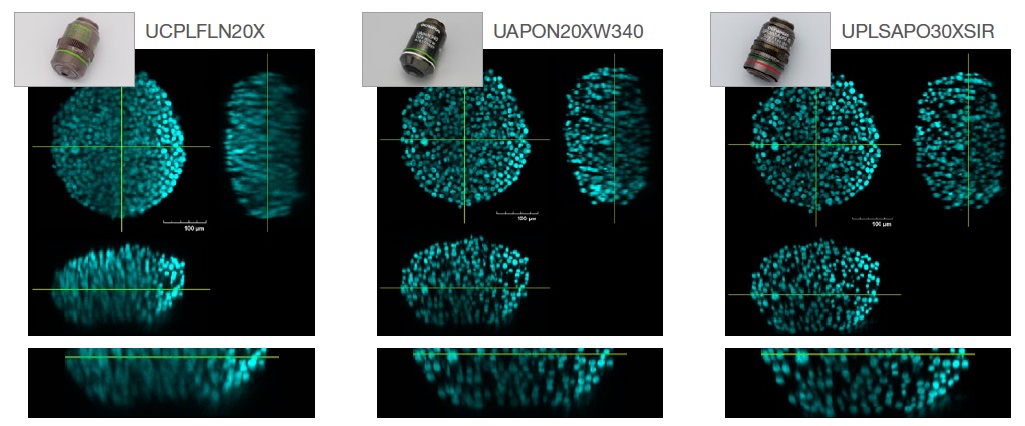
図2. 対物レンズの選択が画像の解像度にもたらす効果
左:ドライ系(RI:1.00、UCPLFLN20X)
中:水浸(RI:1.33、UAPON20XW340)
右:シリコーンオイル浸(RI:1.40、UPLSAPO30XSIR)
図2に示すように、RIを一致させるために最適な対物レンズを選択することは、明瞭な画像を取得して3次元サンプルの形態をより正確に理解するのに役立ちます。
スフェロイドの透明化が3次元定量解析にもたらす効果
3次元サンプルを透明化して、適切な対物レンズを使用して複数枚のZ面画像を取得することにより、3次元サンプルを定量的に解析することができます。DAPIで染色したHT-29スフェロイドの透明化したものと透明化していないものについて、3次元細胞解析ソフトウェアNoviSightを使用して3次元細胞数カウントを行いました。また、浸液の点で異なる対物レンズを使用して取得した3次元画像間で、細胞数カウント精度を比較しました(図2)。トリプシン処理して細胞数を手動でカウントすることによって、スフェロイドの細胞数を確認しました。
透明化されていないスフェロイド内で、NoviSightソフトウェアの細胞数解析によって検出された細胞は、(トリプシン処理されたスフェロイドと比べて)全細胞の20%未満でした。一方、透明化されたスフェロイド内でソフトウェアによって検出された細胞は、全細胞の90%を超えていました(図3)。
ドライ系対物レンズの画像では、おそらく、低S/N比による誤認識が原因で、トリプシン処理されたスフェロイドと比べて細胞数が多くなっていると考えられます(図3の赤い長方形を参照)。また、水浸対物レンズの画像では、ソフトウェアはほぼ完全に核を検出しましたが、スフェロイドの深部にある核を見落としていました(図3の黄色い長方形)。
しかし、シリコーンオイル浸対物レンズの画像では、ソフトウェアは核を完全に認識していました(図3の緑色の長方形)。
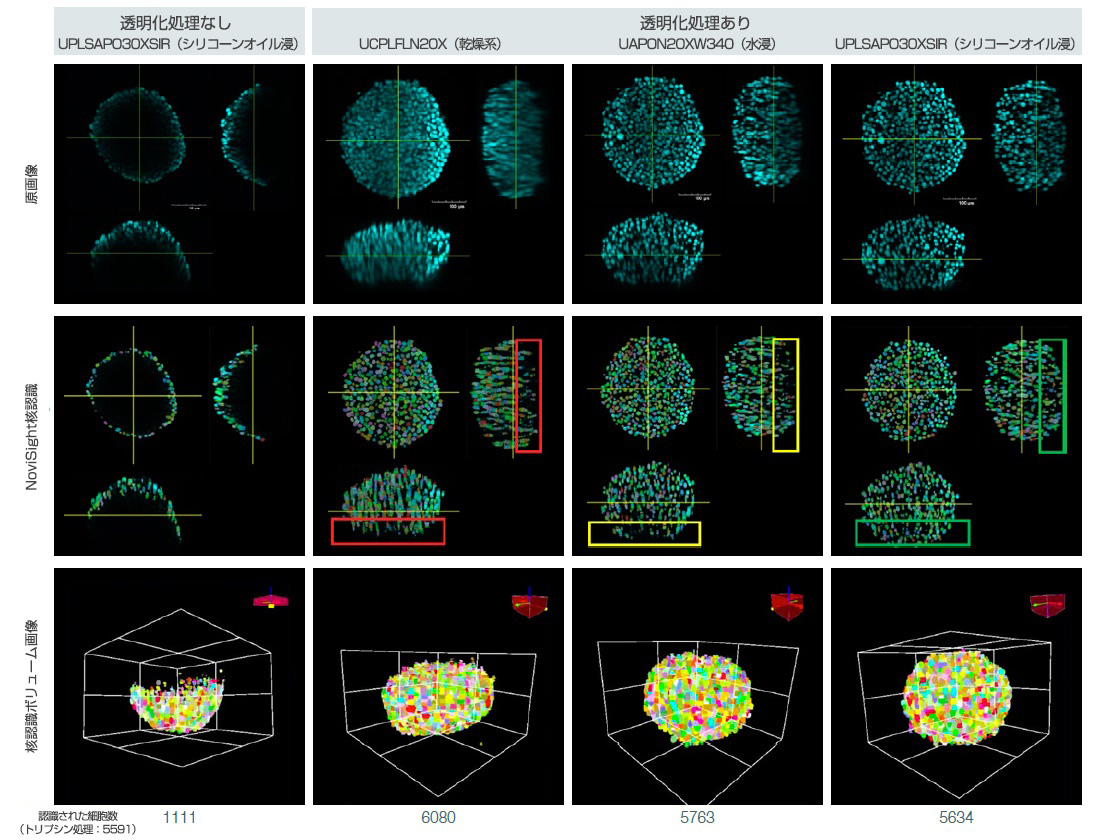
図3. スフェロイドの透明化と対物レンズの選択が3次元細胞数カウントにもたらす効果
結論
透明化技術により、サンプルの深部にある細胞をカウントして、3次元定量解析を行うことができました。
参考文献
- Peng Wan et al., Evaluation of seven optical clearing methods in mouse brain, Neurophotonics (2018)
- Douglas S. Richardson et a., Clarifying Tissue Clearing, Cell (2015)
- Hama et al., ScaleS: an optical clearing palette for biological imaging, Nat Neurosci. (2015)
著者
Mayu Ogawa(オリンパス)
このアプリケーションノートに関連する製品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
このページはお住まいの地域ではご覧いただくことはできません。